Mangāna oksīds (MnO2) Ķīmiskā struktūra, īpašības un lietošanas veidi
The mangāna oksīds (MnO2) ir neorganisks ķīmisks savienojums, ko veido elements mangāns ar oksidācijas numuru +4 un skābekli, kura oksīdu veidošanās oksidācijas skaits ir -2. Tas ir zināms arī ar mangāna (IV) oksīda un mangāna anhidrīda nosaukumiem.
Tas ir ciets no tumšas līdz melnai kafijai. Tas ir dabā kā minerāls pirolusīts, melns un kristalizēts veidojošs dendrits (sazarotu pagarinājumu). To var iegūt kā melnu atlikumu reakcijā starp etilēnu un kālija permanganātu pēc glikola veidošanās ar kālija permanganāta oksidējošo iedarbību..

Stikla rūpniecībā tas ir ļoti svarīgs, jo tā ir oksidējoša viela, jo tā novērš melno krāsu, kas nāk no dzelzs savienojumiem, un pārveido tos melnā krāsā..
Indekss
- 1 Ķīmiskā struktūra
- 2 Rekvizīti
- 3 Lietojumi
- 3.1. Kā katalizators
- 4 Ietekme uz veselību
- 5 Atsauces
Ķīmiskā struktūra
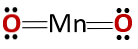
Savienojuma ķīmiskā struktūra atbilst anhidrīda, nevis bāzes oksīda struktūrai, kā tas būtu sagaidāms, jo tas sastāv no metāla un nemetāla..
Šis īpašais gadījums ir saistīts ar mangāna uzvedību dažādos oksidācijas stāvokļos. Tādējādi oksidācijas stāvokļiem +2 un +3 veido oksīdus MnO un Mn2O3 attiecīgi, reaģējot ar ūdeni, tie veido attiecīgi mangāna hidroksīdu un mangāna hidroksīdu.
Tomēr Mn2O3 nedaudz skābā vidē tā darbojas kā anhidrīds. Ar oksidācijas stāvokli +4, +6 un +7, MnO2, MnO3 un MnO4 reaģējot ar ūdeni, tās veido skābes.
Nedaudz skābā vidē MnO2 tā darbojas kā bāzes oksīds, tāpēc tā var veidot atbilstošu hidroksīdu.

Jāatceras, ka šajā gadījumā nav pieminētas amfoteriskās īpašības, saskaņā ar kurām savienojums var rīkoties kā skābe vai bāze. Tas ir īpašs Mn uzvedības gadījums.
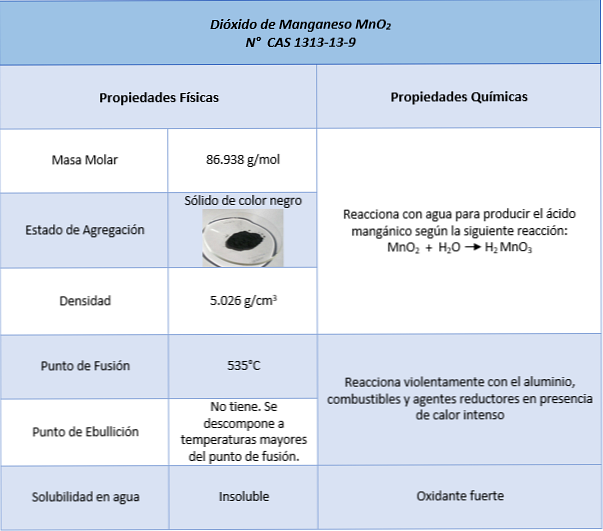
Rekvizīti
Lietojumi
- To lieto kā mangāna avotu
- Kā oksidētājs sārma baterijās
- Stikla, keramikas un porcelāna krāsas.
- Iegūstot hloru un jodu.
- Ūdeņraža peroksīda sadalīšanās gāzveida skābekļa un ūdens veidošanai.
- Kālija hlorāta sadalīšanās reakcijā gāzveida skābekļa un kālija hlorīda ražošanai.
- Izšķīdināts acetonā vai dihlormetānā, oksidē primāros spirtus uz aldehīdiem un sekundāri no ketoniem..
- Sārmu bateriju ražošana.
Kā katalizators
Tas attiecas uz oksīda reducēšanas reakcijām, lai likvidētu sulfīdus, piemēram, H2S un katjoni, piemēram, Fe+2 un Mn+2 , gruntsūdeņos atrastais arsēns un radio, kas ir piesārņoti ar šāda veida savienojumiem.
Šo piesārņojumu var radīt vai nu nekontrolēta toksisku materiālu izgāšana, mazgājot piesārņoto augsni, vai arī ķīmisku elementu klātbūtnē, veicot ūdens ieguvi..
MnO2 Augsta tīrība, kas iegūta no pirolusīta, ko izmanto kā filtru (Filox), ir visefektīvākais līdzeklis, lai noņemtu šīs klases piemaisījumus no gruntsūdeņiem..
Ietekme uz veselību
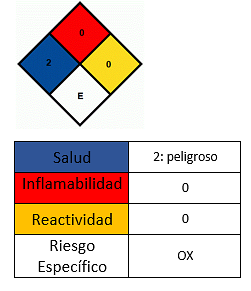
- Izvairīties no saskares ar ādu.
- Kontakta gadījumā nomazgājiet attiecīgo zonu.
- Neieelpojiet pulverus.
- Saskare ar acīm var būt kairinoša un apsārtusi. Nomazgājiet ar lielu daudzumu ūdens, ļaujiet ūdenim cauri acīm un nopietnas palīdzības gadījumā pieprasīt medicīnisko palīdzību.
- Saskaroties ar ādu, novēro kairinājumu un apsārtumu. Nomazgājiet skarto zonu ar lielu daudzumu ūdens un ziepēm.
- Ilgstoša saskare ar ādu noņem dabisko tauku, izraisot dermatītu.
- Ieelpošana var izraisīt gripai līdzīgu stāvokli (metāla dūmi). Stāvokli raksturo augsts drudzis, drebuļi, sausa mute un kakls, muskuļu sāpes un galvassāpes.
- Tas var kairināt elpceļus un palielināt elpceļu infekciju (pneimoniju). Nav iespējama neorganiskas mangāna sāļu uzsūkšanās ar plaušām, bet var rasties hroniska saindēšanās..
- Hroniska mangāna dioksīda putekļu vai dūmu iedarbība ilgtermiņā var ietekmēt centrālo nervu sistēmu un izraisīt Parkinsona slimības attīstību, staigāšanas grūtības, muskuļu spazmas un uzvedības izmaiņas.
- Norīšana var izraisīt sāpes vēderā un sliktu dūšu.
- Tas nav uzliesmojošs, bet tas palīdz izplatīt uguni kvēlspuldzēs. Karsējot līdz temperatūrai virs 535 ° C, viela sadalās līdz mangāna oksīdam (III) Mn2O3 un skābeklis, kas ir uzliesmojošs un palielina ugunsgrēka risku. Šajā gadījumā ugunsgrēks ir jāizdzēš ar putām vai oglekļa dioksīdu.
- Izšļakstīšanās gadījumā nelietojiet savienojumu bez pienācīgas individuālās aizsardzības.
- Uzglabāt savienojumu cieši noslēgtos traukos aukstā un sausā vietā un prom no nesaderīgām vielām, piemēram, organiskiem materiāliem un degošiem materiāliem..
- Uzglabāšanas vietai jābūt sausai un grīdām jābūt izturīgām pret skābju koroziju un ar labu drenāžu..
- Jāizmanto individuālie aizsarglīdzekļi, piemēram, cimdi, aizsargbrilles, anti-tvaika filtra maskas, putekļi un dūmi.
Atsauces
- B, (2015), Mangāna dioksīds, Karaliskā ķīmijas biedrība - Ķīmijas pasaule, iegūta no chemistryworld.com
- Karal, (2014), Mangneso dioksīds, Drošības datu lapa, Atgūts no, karal.com.mx
- Jūsu virtuālais skolotājs (2015-02-25). Mangāna neorganiskie savienojumi (1. īpašais gadījums) - teorētiskā nodarbība), iegūti no youtube.com
- Ecured, (s.f), mangāna dioksīds, reģenerēts no ecured.cu
- Angarita G, Johnny., (2017), Mangāna dioksīds: izcila tehnoloģija. Hydrotec, atgūti no hidrotecocr.com
- Fernández, G., (2015), MnO mangāna dioksīds2/ acetons, Organiskā ķīmija, Atgūts no quimicaorganica.net
- Tronox, (2011), mangāna dioksīds, drošības datu lapa, atgūts no tronox.com


