Litija oksīda formula, īpašības, riski un izmantošana
The litija oksīds ir neorganisks ķīmisks savienojums ar formulu Li2Vai tas, kas veidojas kopā ar nelieliem litija peroksīda daudzumiem, kad litija metāls tiek sadedzināts gaisā un apvienots ar skābekli.
Līdz 1990. gadiem metāla un litija tirgū dominēja ASV ražojumi no minerālu atradnēm, bet 21. gadsimta sākumā lielākā daļa produkcijas tika iegūta no avotiem ārpus ASV; Austrālija, Čīle un Portugāle bija nozīmīgākie piegādātāji pasaulē. Bolīvijai ir puse litija noguldījumu pasaulē, bet tas nav liels ražotājs.
Svarīgākais komerciālais veids ir litija karbonāts, Li2CO3, ražoti no minerāliem vai sālījumiem, izmantojot vairākus dažādus procesus.
Kad litijs tiek sadedzināts gaisā, galvenais produkts ir litija oksīda baltais oksīds, Li2O. Tiek ražots arī litija peroksīds, Li2O2, arī balts.
To var izdarīt arī termiski sadalot litija hidroksīdu, LiOH vai litija peroksīdu, Li2O2
4Li (s) + O2(g) → 2Li2O (s)
2LiOH (s) + siltums → Li2O (s) + H2O (g)
2Li2O2(s) + siltums → 2Li2O (s) + O2(g)
Fizikālās un ķīmiskās īpašības
Litija oksīds ir balta cietviela, kas pazīstama kā litija, kurai trūkst aromāta un sāļās garšas. Tās izskats parādīts 2. attēlā (Nacionālais biotehnoloģijas informācijas centrs, 2017).

2. attēls: litija oksīda izskats
Litija oksīds ir kristāli ar antiflorīta ģeometriju, kas ir līdzīga nātrija hlorīda ģeometrijai (kubiskais centrs uz sejām). Tās kristāliskā struktūra ir parādīta 3. attēlā (Mark Winter [Šefīldas Universitāte un WebElements Ltd, 2016].
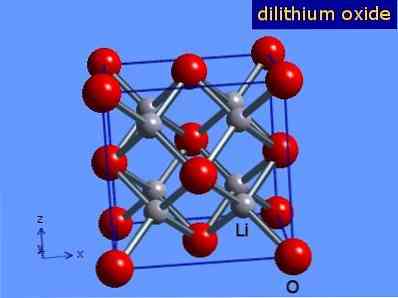
3. attēls: litija oksīda kristāliskā struktūra.
Tā molekulmasa ir 29,88 g / mol, tās blīvums ir 2,013 g / ml un kausēšanas un viršanas temperatūra ir attiecīgi 1438 ° C un 2066 ° C. Savienojums ir ļoti labi šķīst ūdenī, alkoholā, ēterī, piridīnā un nitrobenzolā (Royal Society of Chemistry, 2015).
Litija oksīds viegli reaģē ar ūdens tvaiku, veidojot hidroksīdu, un ar oglekļa dioksīdu veido karbonātu; tāpēc tas ir jāuzglabā un jāapstrādā tīrā un sausā atmosfērā.
Oksīda savienojumi neizraisa elektrību. Tomēr daži strukturēti perovskīta oksīdi ir elektroniski vadītāji, kas tiek izmantoti cieto oksīdu kurināmā elementu un skābekļa ģenerēšanas sistēmu katodā..
Tie ir savienojumi, kas satur vismaz vienu skābekļa anjonu un vienu metālu katjonu (American Elements, S.F.)..
Reaktivitāte un apdraudējumi
Litija oksīds ir stabils savienojums, kas nav savienojams ar spēcīgām skābēm, ūdeni un oglekļa dioksīdu. Mūsuprāt, litija oksīda ķīmiskās, fizikālās un toksikoloģiskās īpašības nav izpētītas un padziļināti.
Litija savienojumu toksicitāte ir atkarīga no to šķīdības ūdenī. Litija jonam ir toksiska ietekme uz centrālo nervu sistēmu. Savienojums ir ļoti kodīgs kairinošs, ja tas nonāk saskarē ar acīm, ādu, ieelpojot vai norijot (ESPI METALS, 1993).
Ja nokļūst acīs, jāpārbauda, vai esat valkājis kontaktlēcas, un nekavējoties noņemiet tās. Acis jāskalo ar tekošu ūdeni vismaz 15 minūtes, turot acu plakstiņus atvērtus. Jūs varat izmantot aukstu ūdeni. Ziedes nedrīkst lietot acīm.
Ja ķīmiskā viela nonāk saskarē ar apģērbu, izņemiet to pēc iespējas ātrāk, aizsargājot savas rokas un ķermeni. Novietojiet cietušo zem dušas.
Ja ķīmiskā viela uzkrājas uz cietušā ādas, piemēram, rokām, viegli un rūpīgi nomazgājiet ādu, kas ir piesārņota ar tekošu ūdeni un bez abrazīvu ziepju. Jūs varat izmantot aukstu ūdeni. Ja kairinājums saglabājas, meklēt medicīnisko palīdzību. Pirms atkārtotas lietošanas nomazgājiet piesārņoto apģērbu.
Ieelpojot, cietušajam jāļauj atpūsties labi vēdināmā vietā. Ja ieelpošana ir smaga, cietušajam pēc iespējas ātrāk jāizvada drošā zonā.
Atbrīvojiet saspringto apģērbu, piemēram, kreklu apkakli, jostas vai kaklasaiti. Ja cietušajam ir grūti elpot, jāievada skābeklis. Ja cietušais nav elpojis, tiek veikta atdzīvināšana no mutes-mutes.
Vienmēr ņemot vērā to, ka personai, kas sniedz palīdzību, var būt bīstama atdzīvināšana no mutes-mutes, ja ieelpots materiāls ir toksisks, infekciozs vai kodīgs.
Visos gadījumos nekavējoties jāmeklē medicīniskā palīdzība (SIGMA-ALDRICH, 2010).
Lietojumi
Litija oksīds tiek izmantots kā keramisko glazūru plūsma un rada zilu ar vara un rozēm ar kobaltu. Litija oksīds reaģē ar ūdeni un tvaiku, veidojot litija hidroksīdu un jābūt izolētam no tiem.
Litija oksīds (Li2O) ar augsto tritija potenciālu ir pievilcīgs kandidāts DT kodolsintēzes spēkstacijas cietajam kultūrmateriālam, pateicoties tā augstajam litija atomu blīvumam (salīdzinot ar citu litija vai metālu litija keramiku) un tā vadītspēju. salīdzinoši augsts siltums (LITIUM OXIDE (Li2O), SF).
Li2Vai tas tiks pakļauts augstām temperatūrām neitronu apstarošanas laikā kodolsintēzes segas darbības laikā. Šādos apstākļos Li radīsies liels skaits apstarošanas defektu2Vai, piemēram, hēlija izraisīta pietūkums, relatīvi augsta termiskā izplešanās, graudu augšana, LiOH (T) veidošanās un nokrišņi zemās temperatūrās un LiOH (T) masas transportēšana augstās temperatūrās.
Turklāt, Li2Vai tas būs pakļauts spriedzēm, ko izraisa atšķirības siltuma izplešanās starp Li2O un strukturālie materiāli. Šīs Li īpašības2Vai arī tie rada sarežģītas inženiertehniskās problēmas gan segas ražošanā, gan dizainā.
Iespējams jauns lietojums ir kobalta un litija oksīda aizstāšana kā katods litija jonu baterijās, ko izmanto, lai darbinātu elektroniskās ierīces no mobilajiem tālruņiem uz klēpjdatoriem, kā arī ar baterijām darbināmām automašīnām (Reade International Corp, 2016).
Atsauces
- Mark Winter [Šefīldas Universitāte un SIA “WebElements” (2016). tīmekļa elementi. Ņemts no litija: dilithium oxide webelements.com.
- Amerikāņu elementi. (S.F.). Litija oksīds. Ņemts no americanelements americanelements.com.
- ESPI METĀLI. (1993, jūnijs). Litija oksīds. Ņemts no espimetals espimetals.com.
- LITIUMOXĪDI (Li2O). (S.F.). Ņemts no ferp.ucsd.edu ferp.ucsd.edu.
- Nacionālais biotehnoloģijas informācijas centrs. (2017. gada 24. jūnijs). PubChem Compound datu bāze; CID = 166630. No PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Litija oksīda pulveris (Li2O). Uzņemts no reade.com
- Karaliskā ķīmijas biedrība. (2015). Litija oksīds.Ņemts no chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Materiāla drošības datu lapa Litija oksīds. Ņemts no chemblink chemblink.com.


