Kas ir neitrāls atoms? (Ar piemēriem)
A neitrāls atoms tas ir tas, kam trūkst elektrības uzlādes dēļ kompensācijas starp tā protonu un elektronu skaitu. Abas ir elektriski uzlādētas subatomiskās daļiņas.
Protoni ir aglomerēti blakus neitroniem un veido kodolu; kamēr elektroni tiek izkliedēti, definējot elektronisko mākoni. Kad protonu skaits atomā, kas ir vienāds ar tā atomu skaitu (Z), ir vienāds ar elektronu skaitu, ir teikts, ka starp elektriskajiem lādiņiem atomu vidū ir kompensācija..
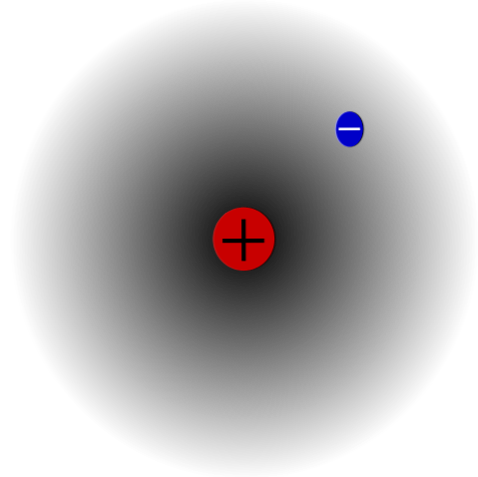
Piemēram, ir ūdeņraža atoms (augšējais attēls), kurā ir protons un elektrons. Protons ir novietots atoma centrā kā tā kodols, kamēr elektrons orbītā ap apkārtējo telpu, atstājot zemākus elektronu blīvuma reģionus, kad tas pārvietojas prom no kodola.
Tas ir neitrāls atoms, jo ir taisnība, ka Z ir vienāds ar elektronu skaitu (1p = 1e). Ja H atoms zaudēja šo vienīgo protonu, atomu rādiuss saruks un protona lādiņš dominē, kļūstot par Hation.+ (hidrons). Ja, no otras puses, tas iegūst elektronu, būtu divi elektroni, un tas kļūtu par H anjonu-- (hidrīds).
Indekss
- 1 Neitrāls atoms pret jonu
- 1,1 Na pret Na+
- 2 neitrālas molekulas
- 3 Piemēri
- 3.1 Skābeklis
- 3.2 Vara
- 3.3. Cēlgāzes
- 3.4 Metāla sakausējumi
- 4 Atsauces
Neitrāls atoms pret jonu
H neitrālā atoma paraugam tika konstatēts, ka protonu skaits ir vienāds ar elektronu skaitu (1p = 1e); situācija, kas nenotiek ar radītajiem joniem elektrona zudums vai ieguvums.
Jonus veido elektronu skaita izmaiņas, vai nu tāpēc, ka atoms uzvar tos (-), vai zaudē tos (+).
Katjona atomā H+ Vienīgā protona valences lādiņš dominē pirms elektrona pilnīgas neesamības (1p> 0e). Tas attiecas uz visiem citiem periodiskākās tabulas smagākiem atomiem (np> ne).
Lai gan pozitīva lādiņa klātbūtne var šķist nenozīmīga, tā diagonāli mainās attiecīgā elementa īpašības.
No otras puses, anjona atoms H- Abu elektronu negatīvais lādiņš dominē viena kodola protona priekšā (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na pret Na+
Labāk zināms ir metāliskā nātrija paraugs. Tās neitrālajam atomam Na, ar Z = 11, ir 11 protoni; tāpēc, lai kompensētu pozitīvos lādiņus, ir jābūt 11 elektroniem (11p = 11e).
Nātrijs, kas ir metālisks elements, ļoti elektropozitīvs, ļoti viegli zaudē elektronus; šajā gadījumā viņš zaudē tikai vienu, viņa valences apvalka (11p> 10e). Tādējādi veidojas Na kations+, kas elektrostatiski mijiedarbojas ar anjonu; kā hlorīds, Cl-, sāls nātrija hlorīds, NaCl.
Metāla nātrijs ir indīgs un kodīgs, savukārt tās katjonu pat šūnu iekšpusē. Tas parāda, kā elementa īpašības var ievērojami mainīties, kad tās iegūst vai zaudē elektronus.
No otras puses, Na anjons- (soduro, hipotētiski) nepastāv; un lai varētu veidoties, tas būtu ārkārtīgi reaktīvs, jo elektronu iegūšana ir pret nātrija ķīmisko dabu. Na- būtu 12 elektroni, kas pārsniedz tās kodola pozitīvo uzlādi (11p<12e).
Neitrālās molekulas
Atomi ir kovalenti saistīti, lai radītu molekulas, kuras var saukt arī par savienojumiem. Molekulā nedrīkst būt izolēti joni; tā vietā ir atomi ar pozitīviem vai negatīviem oficiāliem maksājumiem. Šie uzlādētie atomi ietekmē molekulas neto uzlādi, pārveidojot to par polatomisko jonu.
Lai molekula būtu neitrāla, tās atomu formālo maksu summa ir vienāda ar nulli; vai, vienkārši, visi tā atomi ir neitrāli. Ja atomi, kas veido molekulu, ir neitrāli, tas arī būs.
Piemēram, jums ir ūdens molekula, H2O. Tā divi H atomi ir neitrāli, tāpat kā skābekļa atoms. Tos nevar attēlot tādā pašā veidā, kā parādīts ūdeņraža atoma attēlā; tā kā, lai gan kodols nemainās, elektroniskais mākonis darbojas.
Hidronija jonu H3O+, no otras puses, tam ir skābekļa atoms ar daļēju pozitīvu lādiņu. Tas nozīmē, ka šajā polomātiskajā jonā tas zaudē elektronu, un tāpēc tā protonu skaits ir lielāks nekā tā elektronu skaits..
Piemēri
Skābeklis
Neitrālajam skābekļa atomam ir 8 protoni un 8 elektroni. Kad tas iegūst divus elektronus, tas veido to, ko sauc par anjona oksīdu, OR2-. Tajā dominē negatīvie lādiņi, kuriem ir vairāk nekā divi elektroni (8p<10e).
Neitrāliem skābekļa atomiem ir augsta tendence reaģēt un saistīties ar sevi, veidojot O2. Tieši šī iemesla dēļ nav atomu vai "brīvs" uz savu likteni un neko nereaģējot. Visas zināmās šīs gāzes reakcijas ir saistītas ar molekulāro skābekli, OR2.
Varš
Vara sastāvā ir 29 protoni un 29 elektroni (papildus neitroniem). Atšķirībā no skābekļa, tā neitrālos atomus var atrast dabā, pateicoties to metāla saitei un relatīvajai stabilitātei.
Tāpat kā nātrijs, tā mēdz zaudēt elektronus, nevis uzvarēt. Ņemot vērā tā elektronisko konfigurāciju un citus aspektus, tas var zaudēt vienu vai divus elektronus, kļūstot par kaļķiem katliem, Cu+, vai kauss, Cu2+, attiecīgi.
Paziņojums+ tai ir vēl viens elektrons (29p<28e), y el Cu2+ ir zaudējis divus elektronus (29p<27e).
Cēlgāzes
Cēlgāzes (He, Ne, Ar, Kr, Xe, Rn) ir viens no nedaudzajiem elementiem, kas pastāv neitrālu atomu formā. To atomu skaits ir attiecīgi 2, 10, 18, 36, 54 un 86. \ t Viņi nesaņem vai nezaudē elektronus; Ksenons, Xe, var veidot savienojumus ar fluoru un zaudēt elektronus.
Metāla sakausējumi
Metāli, ja tie ir pasargāti no korozijas, var saglabāt neitrālos atomus, kurus savieno metāla saites. Sakausējumos, metālu cietos šķīdumos atomi paliek (galvenokārt) neitrāli. Piemēram, misiņā ir neitrāli Cu un Zn atomi.
Atsauces
- Jetser Carasco. (2016). Kas ir neitrāls atoms? Saturs iegūts no: ievads-to-physics.com
- Marķējumi, Samuel. (2017. gada 25. aprīlis). Neitrālas atomu piemēri. Science. Saturs iegūts no: sciencing.com
- Chem4kids. (2018), skatoties uz joniem. Saturs iegūts no: chem4kids.com
- Whitten, Davis, Peck & Stanley. (2008). Ķīmija (8. izdevums). CENGAGE Learning.
- Shiver & Atkins. (2008). Neorganiskā ķīmija (Ceturtais izdevums). Mc Graw kalns.


