Ziehl-Neelsen Stain Foundation, reaģenti un tehnika
The Ziehl-Neelsen traipu krāsošanas paņēmienā, lai noteiktu alkohola skābes izturīgus mikroorganismus (AAR). Šīs mikrobioloģijas procedūras nosaukums attiecas uz tā autoriem: bakteriologs Franz Ziehl un patologs Frīdrihs Neelsens..
Šī metode ir diferenciālas krāsas veids, kas nozīmē dažādu krāsu izmantošanu, lai radītu kontrastu starp struktūrām, kuras vēlaties novērot, diferencēt un vēlāk identificēt. Ziehl-Neelsen traipu izmanto, lai noteiktu noteiktu mikroorganismu veidus.
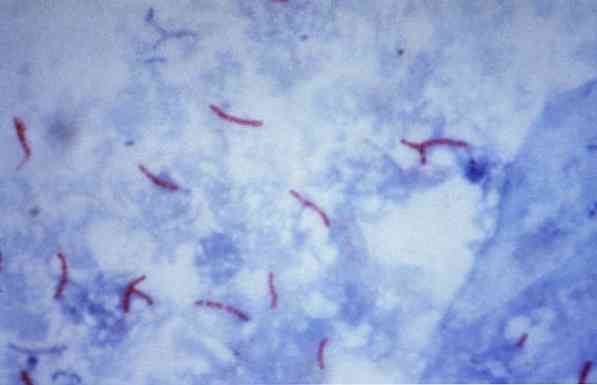
Daži no šiem mikroorganismiem ir mikobaktērijas (piemēram,, Mycobacterium tuberculosis), nocardias (piemēram,, Nocardia sp.) un daži vienšūnas parazīti (piemēram,, Cryptosporidium parvum). Daudzas baktērijas var klasificēt, izmantojot parasto metodi, ko sauc par Gramu.
Tomēr dažām baktēriju grupām ir vajadzīgas citas metodes to identificēšanai. Tādas metodes kā Ziehl-Neelsen krāsošana prasa krāsvielu kombināciju ar karstumu, lai nostiprinātu pirmo šūnu sienu..
Tad rodas krāsas maiņas process, kas ļauj sasniegt divus rezultātus: pretestība vai jutība pret krāsas izmaiņām ar skābēm un spirtiem.
Indekss
- 1 Fonds
- 1.1. Sekundārā krāsošana
- 2 Reaģenti
- 2.1. Primārā krāsošana
- 2.2. Krāsošanas šķīdums
- 2.3. Sekundārā krāsošana (anti-krāsviela)
- 3 Tehnika
- 3.1. Skābes ātri krāsošanas procedūra
- 4 Atsauces
Fonds
Šīs krāsošanas metodes pamatā ir šo mikroorganismu šūnu sienu īpašības. Sienu veido taukskābju veids, ko sauc par mikolskābi; Tās raksturo ļoti garas ķēdes.
Kad taukskābēm ir ļoti garas struktūras, tās var vieglāk saglabāt krāsvielas. Dažas baktēriju ģints ir ļoti grūti krāsot ar Grama traipu, pateicoties augstajam mikolskābes saturam šūnu sienā.
Ziehl-Neelsen krāsā tiek izmantots fenola savienojums karbola fuksīns, kas ir pamata krāsviela. Tas ir spējīgs mijiedarboties ar šūnu sienas taukskābēm, kas ir vaskveida tekstūra istabas temperatūrā.
Karbola fuksīna krāsošana tiek uzlabota siltuma klātbūtnē, jo vasks kūst un krāsu molekulas straujāk pārvietojas šūnu sienā.
Skābe, kas tiek izmantota vēlāk, kalpo, lai izmainītu šūnas, kas nav iekrāsotas, jo to siena nebija pietiekami saistīta ar krāsvielu; tāpēc skābes krāsas samazināšanas līdzeklis var izņemt skābes krāsu. Šūnas, kas iztur šīs krāsas izmaiņas, tiek sauktas par skābi izturīgām.
Sekundārā krāsošana
Pēc parauga krāsas maiņas tas ir kontrastēts ar citu krāsvielu, ko sauc par sekundāro krāsu. Parasti tiek izmantots metilēnzils vai malahīts.
Sekundārā krāsviela iekrāso fona materiālu un līdz ar to rada kontrastu struktūrām, kas krāsotas pirmajā posmā. Tikai krāsas krāsas šūnas absorbē otru krāsu (anti-traipu) un iegūst to krāsu, savukārt skābes izturīgas šūnas saglabā sarkano krāsu.
Šo procedūru bieži izmanto, lai identificētu Mycobacterium tuberculosis un Mycobacterium leprae, ko sauc par skābju bacilām.
Reaģenti
Primārā krāsošana
Tiek izmantots 0,3% karboksīna fuksīns (filtrēts). Šo krāsu sagatavo no spirta: fenola maisījuma etanolā (90%) vai metanola (95%), un šajā maisījumā izšķīdina 3 gramus pamata fuksīna..
Krāsošanas šķīdums
Šajā solī var izmantot 3% spirta skābes vai 25% sērskābes šķīdumus.
Sekundārā krāsviela (anti-krāsviela)
Krāsas, ko parasti izmanto, lai veiktu kontrastu paraugos, parasti ir 0,3% metilēnzilā. Tomēr var izmantot arī citus, piemēram, 0,5% malahīta zaļo.
Tehnika
Acid ātri krāsošanas procedūra
Sagatavojiet baktēriju uztriepes
Šis preparāts tiek gatavots uz tīra un sausa slaida, ievērojot piesardzības pasākumus.
Žāvēšanas žāvēšana
Ļaujiet uztriepei izžūt istabas temperatūrā.
Sildiet paraugu
Paraugam jābūt apsildītam, uzliekot uguni uz apakšas. Piestiprināšanu ar alkoholu var izdarīt, ja uztriepes nav sagatavotas ar krēpām (to apstrādā ar nātrija hipohlorītu, lai to balinātu) un ja tas netiks nekavējoties krāsots..
M. tuberculosis Tas tiek izvadīts ar balinātāju un krāsošanas procesā. Neārstētas krēpu termofiksēšana nenogalinās M. tuberculosis, tā kā fiksācija ar alkoholu ir baktericīda.
Pārklājiet traipu
Traipu pārklāj ar karbola fuksīna šķīdumu (primāro pamata traipu).
Karsējiet traipu
Tas tiek darīts 5 minūtes. Jums vajadzētu pamanīt tvaiku izdalīšanos (aptuveni 60 ° C). Ir svarīgi nepārkarsēt un izvairīties no parauga dedzināšanas.
Kas attiecas uz traipu sildīšanu, jāievēro īpaša piesardzība, ja silda fuksīna karbolu, īpaši, ja krāsošana tiek veikta uz paplātes vai citā traukā, kurā no iepriekšējās traipiem ir savāktas viegli uzliesmojošas ķīmiskas vielas..
Ar slaidiem, izmantojot iepriekš apgaismotu tamponu, kas iepriekš samitrināts ar dažiem pilieniem skābes spirta, metanola vai 70% etanola, ir jāizmanto tikai neliela liesma. Izvairieties no lielā etanolā iemērcta tampona, jo tas ir ugunsbīstamība.
Nomazgājiet traipu
Šī mazgāšana jāveic ar tīru ūdeni. Ja krāna ūdens nav tīrs, mazgājiet uztriepes ar filtrētu vai destilētu ūdeni, vēlams.
Pārklājiet uztriepes ar skābu spirtu
Šim skābajam spirta daudzumam jābūt 3%. Pārklājums tiek veikts 5 minūtes vai kamēr uztriepes ir pietiekami mainījušās, tas ir, gaiši rozā.
Jāņem vērā, ka skābais spirts ir uzliesmojošs; tāpēc tas ir jāizmanto ļoti uzmanīgi. Izvairieties no aizdegšanās avotiem.
Nomazgājiet traipu
Mazgāšana jāveic ar tīru, destilētu ūdeni.
Pārklājiet uztriepes ar krāsu
Tas var būt zaļš malahīts (0,5%) vai metilēnzilais (0,3%) krāsu 1 vai 2 minūtes, izmantojot garāko laiku, ja uztriepes ir plānas.
Nomazgājiet traipu
Tīru ūdeni atkārtoti jāizmanto (destilēts).
Noteciniet
Slaidu aizmugurē jānotīra un traipu novieto uz drenāžas plaukta, lai tā būtu žāvēta gaisā (neizmantojiet absorbējošu papīru žāvēšanai)..
Pārbaudiet mikroskopā uztriepi
Jāizmanto 100X mērķis un iegremdēšanas eļļa. Sistemātiski skenējiet uztriepes un pierakstiet attiecīgos novērojumus.
Interpretējiet rezultātus
Teorētiski, sarkanā krāsā krāsoti mikroorganismi tiek uzskatīti par skābju pozitīviem (AAR +).
Gluži pretēji, ja mikroorganismi ir iekrāsoti zilā vai zaļā krāsā, atkarībā no krāsvielas, ko izmanto kā pretkrāsu, tos uzskata par negatīvām spirta izturīgām skābēm (AAR-).
Atsauces
- Apurba, S. & Sandhya, B. (2016). Praktiskās mikrobioloģijas pamati (1. izdevums). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Mikrobioloģija ar slimībām, ko veic ķermeņa sistēma (4. izdevums). Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, A. (1996). Ievada mikrobioloģija (1. izdevums). Cambridge University Press.
- Morello, J., Granato, P. Vilsons, M. & Mortons, V. (2006). Laboratorijas rokasgrāmata un darbgrāmata mikrobioloģijā: lietojumi pacientu aprūpē (11. izdevums). McGraw-Hill Izglītība.
- Vasanthakumari, R. (2007). Mikrobioloģijas mācību grāmata (1. izdevums). B.I. Publikācijas PVT.


