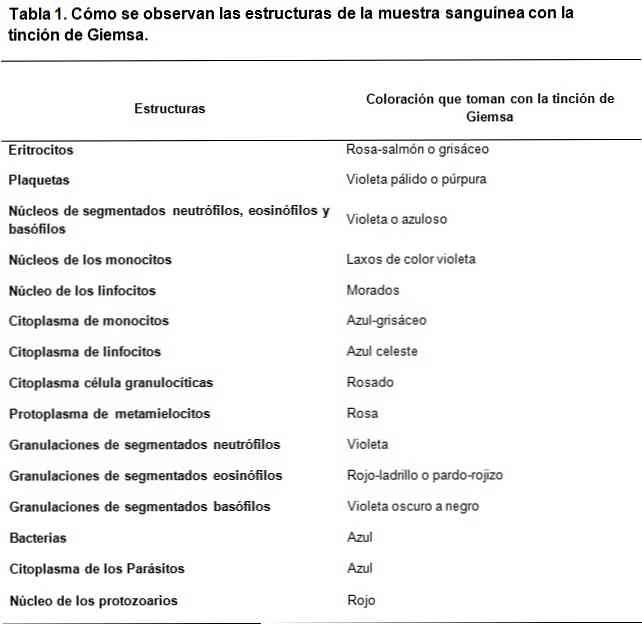
Giemsa krāsošanas pamats, materiāli, tehnika un pielietojums
The Giemsa traipi ir klīnisko paraugu krāsošanas veids, kas balstīts uz skābes un bāzes krāsvielu maisījumu. Tās izveidi iedvesmoja Romanowsky paveiktais darbs, kur Vācijā radies ķīmiķis un bakteriologs Gustavs Giemsa to papildināja, pievienojot glicerīnu, lai stabilizētu savienojumus..
Romanowsky oriģinālajai tehnikai radītās izmaiņas ļāva ievērojami uzlabot mikroskopiskos novērojumus, tāpēc metode tika kristīta ar Giemsa traipu..
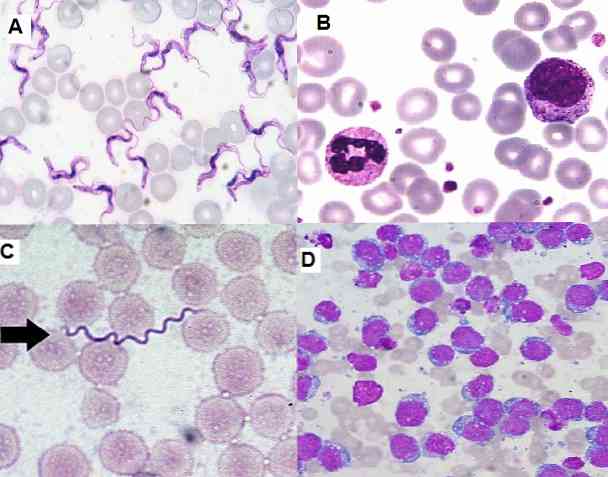
Tā kā tā ir vienkārša metode, kas ir ļoti funkcionāla un ekonomiska, to klīniskajā laboratorijā plaši izmanto hematoloģisko uztriepes, kaulu smadzeņu paraugus un audu sekcijas..
Giemsa krāsošanas tehnika ir ļoti noderīga citoloģiskiem pētījumiem, jo tā ļauj noteikt specifiskas šūnu struktūras. Šī metode iekrāso šūnu citoplazmas, kodolus, kodolus, vakuolus un granulas, lai varētu atšķirt pat smalkas hromatīna pēdas..
Turklāt var konstatēt būtiskas izmaiņas kodola lielumā, formā vai krāsā, kur ir iespējams vizualizēt kodola-citoplazmas attiecību zudumu..
No otras puses, tas ļauj identificēt nenobriedušas šūnas kaulu smadzenēs un perifēriskajā asinīs, kas ir svarīgas nopietnu slimību, piemēram, leikēmijas, diagnosticēšanai. Cita starpā ir iespējams noteikt arī hemoparazītus, papildus un intracelulāras baktērijas, sēnītes.
Citogenetikā tas ir diezgan izmantots, jo ir iespējams pētīt šūnu mitozi.
Indekss
- 1 Giemsa krāsas pamatojums
- 2 Materiāli
- 2.1 Materiāli mātes šķīduma pagatavošanai
- 2.2 Mātes šķīduma sagatavošanas veids
- 2.3 Materiāli buferšķīduma pagatavošanai
- 2.4. Krāsas galīgā sagatavošana
- 2.5 Papildu materiāli, kas nepieciešami krāsojuma veikšanai
- 3 Tehnika
- 3.1. Krāsošanas process
- 4 Komunālie pakalpojumi
- 4.1 Hematoloģija
- 4.2 Mikoloģija
- 4.3. Bakterioloģija
- 4.4 Parazitoloģija
- 4.5. Citoloģija
- 4.6. Cytogenetics
- 5 Pētījums, kas parāda Giemsa krāsošanas efektivitāti
- 6 Ieteikumi par labu krāsošanu
- 7 Bieži pieļautas kļūdas Giemsa krāsošanā
- 7.1. Īpaši zila krāsa
- 7.2 Pārmērīgi rozā krāsošana
- 7.3. Nokrišņu klātbūtne uztriepēs
- 7.4 Morfoloģisko artefaktu klātbūtne
- 8 Uzglabāšanas režīms
- 9 Atsauces
Giemsa krāsas pamatojums
Romanowsky tipa krāsvielas ir balstītas uz kontrastu starp skābi un bāzes krāsvielām, lai panāktu pamata un skābes struktūru krāsošanu. Kā redzams, skābes krāsvielu afinitāte ir krāsot pamata struktūras un otrādi.
Bāzes krāsviela ir metilēnzils un tā oksidētie atvasinājumi (Azure A un Azure B), savukārt skābes krāsviela ir eozīns..
Šūnu skābes struktūras cita starpā ir nukleīnskābes, segmentēto basofilu granulas, tāpēc tās tiks krāsotas ar metilēnzilu.
Tādā pašā veidā šūnu pamatstruktūras ir hemoglobīns un dažas granulas, piemēram, tās, kas atrodas segmentētajos eozinofilos; tie tiks krāsoti ar eozīnu.
No otras puses, sakarā ar to, ka metilēnzilai un debeszilai ir raksturīgas metahromatiskās krāsvielas, tās var nodrošināt dažādām struktūrām mainīgu toņu atkarībā no to polianionu slodzes..
Tādā veidā pamata un skābes krāsvielu stratēģiskā kombinācija spēj attīstīt plašu krāsu spektru atbilstoši katras struktūras bioķīmiskajām īpašībām, staigājot pa gaiši zilām, tumši zilām, violetām un violetām toņiem skābās struktūras gadījumā..
Kaut arī eozīna piedāvātā krāsa ir stabilāka, tā rada krāsas starp sarkanīgi oranžu un lašiem.
Materiāli
Materiāli mātes šķīduma pagatavošanai
Krājumu šķīduma pagatavošanai nepieciešams sver 600 mg pulvera Giemsa krāsas, mērot 500 cc acetona nesaturošu metilspirtu un 50 cm3 neitrāla glicerīna..
Mātes šķīduma sagatavošanas veids
Ievietojiet smago Giemsa pulveri javā. Ja ir gabali, tie ir jāapsmidzina. Pēc tam pievieno ievērojamu daudzumu izmērītā glicerīna un labi samaisa. Iegūtais maisījums ielej ļoti tīru dzintara pudeli.
Pārējo glicerīnu ievieto javā. Atkal samaisiet, lai notīrītu atlikušo krāsu, kas ir iestrēdzusi pie javas sienām, un ielej tajā pašā pudelē.
Pudelīti nosedz un 2 stundas pārvadā ūdens vannā 55 ° C temperatūrā. Bain-marie vannā viegli samaisiet maisījumu ik pēc pusstundas.
Pēc tam maisījumam ļauj atdzist, lai ievietotu spirtu. Agrāk daļa izmērītā spirta tiek ievietota javā, lai pabeigtu mazgāšanu, kas palicis no krāsvielas, un tad pievieno maisījumam kopā ar pārējo spirtu..
Šim preparātam jāļauj nobriest vismaz 2 nedēļas. Mātes šķīduma daļa jāfiltrē.
Lai izvairītos no preparāta inficēšanās, ieteicams nodot daļu, kas pastāvīgi tiks izmantota mazam dzintara pudelei ar pilinātāju. Uzlādējiet katru reizi, kad beidzas reaģents.
Materiāli buferšķīduma pagatavošanai
No otras puses, buferšķīdums ar pH 7,2 ir sagatavots šādi:
Nosver 6,77 g (bezūdens) nātrija fosfāta (NaHPO4), 2,59 g kālija dihidrogēnfosfāta (KH)2PO4) un destilētu ūdeni līdz 1000 cm3.
Krāsas galīgā sagatavošana
Galīgā krāsošanas šķīduma pagatavošanai tiek mērīts 2 ml filtrētā izejas šķīduma un sajaukts ar 6 ml buferšķīduma. Maisījumu sajauc.
Būtisks fakts, kas jāņem vērā, ir tas, ka krāsvielas sagatavošanas metodes var mainīties atkarībā no komerciālās mājas.
Papildu materiāli, kas nepieciešami krāsošanai
Neatkarīgi no aprakstītajiem materiāliem būtu jānodrošina krāsu tilti, ūdens ekrāni vai mazgāšanas mazgāšanas līdzeklis, priekšmetu vai vāku loksnes, hronometrs, lai kontrolētu krāsošanas laikus, un papīrs vai kāds materiāls, ko var izmantot sausināšanai ( marle vai kokvilna).
Tehnika
Krāsošanas process
1) Pirms krāsošanas paraugam jābūt izkliedētam uz tīra slaida..
Paraugi var būt asinis, kaulu smadzenes, histoloģisko audu gabali vai dzemdes kakla paraugi. Ieteicams, lai ārpuses būtu plānas un pirms krāsošanas tām jābūt 1 vai 2 stundām.
2) Visas krāsas, kas jums ir jāpārklāj, tiek novietotas uz krāsaina tilta. Vienmēr strādājiet tādā pašā kārtībā un labi identificējiet katru lapu.
3) Novietojiet dažus pilienus 100% metilspirta (metanola) uz uztriepes un atstājiet 3 līdz 5 minūtes, lai noteiktu un dehidrētu paraugu..
4) Izmetiet loksnē esošo metanolu un ļaujiet tai nožūt.
5) Pēc izžūšanas galīgo krāsošanas šķīdumu ievieto ar pilinātāju, līdz visa loksne ir pārklāta. Atstājiet uz 15 minūtēm. Daži autori iesaka līdz 25 min. Atkarīgs no komerciālās mājas.
6) Noteciniet krāsu un mazgājiet uztriepes ar destilētu ūdeni vai ar 7,2 buferšķīdumu.
7) Blotpapīrs ļauj plāksnēm izžūt brīvā dabā, vertikāli ar atbalsta palīdzību.
8) Noslaukiet slaida aizmuguri ar marli vai kokvilnas tamponu, kas samitrināts ar spirtu, lai noņemtu atlikušo krāsu.
Komunālie pakalpojumi
Giemsa krāsošanas metodi izmanto vairākās jomās, tai skaitā: hematoloģijā, mikoloģijā, bakterioloģijā, parazitoloģijā, citoloģijā un citoģenētikā..
Hematoloģija
Tā ir visbiežāk lietotā šī krāsošanas lietderība. Ar to mēs varam identificēt katru no šūnām, kas atrodas kaulu smadzeņu vai perifēro asiņu paraugos. Kā arī novērtējot katras sērijas skaitu, spējot atklāt leikocitozi vai leikopēniju, trombocitopēniju utt..
Tā kā tā ir jutīga pret nenobriedušām šūnām, tā ir svarīga akūtu vai hronisku leikēmiju diagnosticēšanai. Ir iespējams diagnosticēt arī anēmiju, piemēram, sirpjveida šūnu slimību, sirpjveida šūnu slimību..
Mikoloģija
Šajā jomā ir parasta to izmantot, lai meklētu Histoplasma capsulatum (intracelulāro dimorfisko sēnīti) audu paraugos.
Bakterioloģija
Hematoloģiskās uztriepes, kas iekrāsotas ar Giemsa, ir iespējams noteikt Borrelias sp pacientiem, kuriem ir slimība, ko sauc par drudzi. Spirochetos ir daudz eritrocītu, paraugos, kas ņemti pēc drudža pīķa.
Ir iespējams arī iztēloties intracelulāras baktērijas kā Rickettsias sp un Chlamydia trachomatis inficētās šūnās.
Parazitoloģija
Parazitoloģijas jomā Giemsa krāsošana ir ļāvusi diagnosticēt parazītiskās slimības, piemēram, malāriju, Chagas slimību un leishmaniasis..
Pirmajos divos parazītos Plasmodium sp un Trypanosoma cruzi attiecīgi tos var vizualizēt inficēto pacientu perifēriskajā asinīs, tos var atrast dažādos posmos atkarībā no slimības fāzes..
Lai uzlabotu asins parazītu meklēšanu, ieteicams lietot Giemsa traipus, kas sajaukti ar May-Grünwald krāsu.
Tāpat, nosakot ādas biopsiju paraugus, kas iekrāsoti ar Giemsa, kur ir konstatēts parazīts, var diagnosticēt arī ādas leishmaniasis..
Citoloģija
Giemsa krāsošana tiek izmantota arī endocervikālo paraugu citoloģiskajai izpētei, lai gan tas nav visbiežāk izmantotā metode šim nolūkam..
Tomēr resursu trūkuma gadījumos var izmantot tādas funkcijas, kas ir līdzīgas Papanicolaou tehnikas piedāvātajai funkcijai un par zemākām izmaksām. Tomēr tai ir nepieciešama eksperta ekspertīze.
Citogenētika
Būtiska Giemsa krāsošanas iezīme ir tā spēja stipri saistīties ar reģioniem, kas bagāti ar DNS adenīniem un timīniem. Tas ļauj DNS vizualizēt šūnu mitozes laikā dažādos kondensācijas stāvokļos.
Šie pētījumi ir nepieciešami, lai noteiktu hromatisko aberāciju, piemēram, dažādo hromosomu reģionu dublēšanos, dzēšanu vai translokāciju..
Pētījums, kas parāda Giemsa krāsošanas efektivitāti
Cannova et al (2016) salīdzināja 3 krāsošanas metodes ādas leishmaniasis diagnosticēšanai.
Šim nolūkam viņi izmantoja paraugus, kas iegūti no eksperimenta dzīvnieka (\ tMesocrisetus auratus) eksperimentāli inokulēti ar Leishmanias.
Autori parādīja, ka Giemsa krāsošana bija labāka par Pap-mart® un Gaffney krāsošanu. Tāpēc viņi uzskatīja, ka Giemsa traipi ir ideāli piemēroti ādas leishmaniasis diagnosticēšanai.
Lielie autora sasniegtie rezultāti ir saistīti ar to, ka Giemsa maisījuma sastāvā esošo krāsvielu kombinācija rada nepieciešamos apstākļus, lai radītu labvēlīgu kontrastu, ļaujot skaidri nošķirt amastigota struktūras, gan iekšēji, gan ekstracelulāri..
Arī citi paņēmieni (Pap-Mart® un Gaffney) to darīja, bet vājākā veidā, un tāpēc bija grūtāk to vizualizēt. Tāpēc Giemsa traipu ieteicams lietot leishmaniasis parazitoloģiskajai diagnozei.
Tāpat Ramírez et al (1994) pētījumā tika novērtēts Giemsa un Lendrum traipu derīgums konjunktīvas uztriepes, lai identificētu Chlamydia trachomatis.
Autori konstatēja, ka Giemsa un Ledrum krāsošanai ir vienāda specifika, bet Giemsa bija jutīgāka.
Tas izskaidro, kāpēc pašlaik Giemsa krāsošana ir visbiežāk izmantota hlamīdiju infekciju diagnosticēšanai, īpaši, ja ir maz resursu..
Ieteikumi par labu krāsošanu
Lokšņu žāvēšanu nedrīkst paātrināt. Piesardzības laiks ir jāgaida, lai to izžāvētu brīvā dabā. Apmēram 2 stundas.
Krāsas tūlīt pēc 2 stundām, lai iegūtu labākus rezultātus.
Lai uztriepes tiktu nostiprinātas un krāsotas labāk, paraugam jābūt sadalītam uz loksnes tā, lai paliktu plāna un vienmērīga slāņa virsma..
Vēlamais asins paraugs ir kapilārs, jo uztriepes veidojas tieši no asins piliena, un tāpēc paraugam nav piedevas, kas veicina šūnu struktūru uzturēšanu..
Tomēr, ja lieto vēnu asinis, EDTA jālieto kā antikoagulants, nevis heparīns, jo pēdējā parasti deformē šūnas.
Bieži pieļautas kļūdas Giemsa krāsošanā
Šīs krāsošanas praksē var pieļaut kļūdas. Tos apliecina pēkšņas struktūru nokrāsu izmaiņas.
Ļoti zila krāsa
Tas var būt saistīts ar:
- Ļoti biezas uztriepes
- Krāsošanas laika pārsniegšana
- Pārāk maz mazgāšanas.
- Reaģentu izmantošana, kas ir krietni virs neitrāla pH (sārmains).
Šādos apstākļos tiek izkropļotas šādu struktūru krāsas, tāpēc eritrocīti, kas mirst rozā laša vietā, izskatās zaļi, eozinofilu granulas, kas būtu krāsojamas sarkanā ķieģeļu krāsā, kļūs zilas vai pelēkas, un tā tālāk būs novirze parastajās tonikās.
Pārmērīgi rozā krāsa
Tas var būt saistīts ar:
- Nepietiekams krāsošanas laiks.
- Ilgstoša vai pārmērīga mazgāšana.
- Slikta žāvēšana.
- Ļoti skābes reaģentu izmantošana.
Šajā konkrētajā gadījumā struktūras, kas parasti ir iekrāsotas zilā krāsā, nebūs gandrīz redzamas, bet rozā krāsotās struktūras būs ļoti pārspīlētas.
Piemērs: eritrocītiem būs spilgti sarkana vai spēcīga oranža krāsa, kodolkromatīns izskatīsies gaiši rozā krāsā, un eozinofilu granulas kļūs spilgti sarkanas..
Nokrišņu klātbūtne
Iemesli var būt:
- Izmantojiet netīras vai slikti mazgātas loksnes.
- Neļaujiet uztriepes labi nožūt.
- Atstājiet stiprinājuma šķīdumu pārāk ilgi.
- Nepietiekama mazgāšana krāsošanas beigās.
- Nepietiekama izmantoto krāsu filtrēšana vai nefiltrēšana.
Morfoloģisko artefaktu klātbūtne
Krāsās var parādīties morfoloģiskie artefakti, kas apgrūtina redzamo struktūru vizualizēšanu un interpretāciju. Tas ir saistīts ar:
- Lietotā antikoagulanta veids, piemēram, heparīns.
- Netīras, bojātas vai taukainas loksnes izmantošana.
Uzglabāšanas režīms
Pēc sagatavošanas krāsviela jāuzglabā istabas temperatūrā (15 - 25 ° C), lai novērstu krāsvielas nokrišanu. Tas jāglabā slēgtā dzintara konteinerā.
Atsauces
- Cannova D, Brito E un Simons M. Krāsu metožu novērtēšana ādas leishmaniasis diagnosticēšanai. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW reaģenti. Giemsa traipi. Versija 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Spānija.
- Clark G. Krāsošanas procedūras (1981), 4thed. Williams & Willkins.
- Lietišķā klīniskā ķīmija Giemsa krāsviela diagnozei in vitro. Izplatītājs: cromakit.es
- Ramírez I, Mejía M, García de la Riva J, Hermes F un Grazioso C. Giemsa un Lendrum traipu derīgums konjunktīvas uztriepes, lai noteiktu Chlamydia trachomatis. Bol no Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Vispārējā mikoloģija. 1994. 2. Ed. Universidad Central de Venezuela, bibliotēkas izdevumi. Venecuēla, Karakasa.
- "Giemsa traipi." Vikipēdija, brīvā enciklopēdija. 2017. gada 1. septembris, 01:02 UTC. 2018. gada 6. decembris, en.wikipedia.org.


