Spore krāsošanas pamats, metodes un izmantošanas veidi
The sporas krāsošana ir metodoloģija, ko izmanto, lai krāsotu rezistences struktūras, kas veido dažas baktēriju ģints, ja tās ir nelabvēlīgos apstākļos; šīs struktūras atbilst izdzīvošanas veidam.
Ir daudzas ģints, kas veido sporas; tomēr galvenās ir Bacillus un Clostridium. Šīs ģints tiek uzskatītas par nozīmīgākām, jo tām ir patogēnas sugas cilvēkiem.
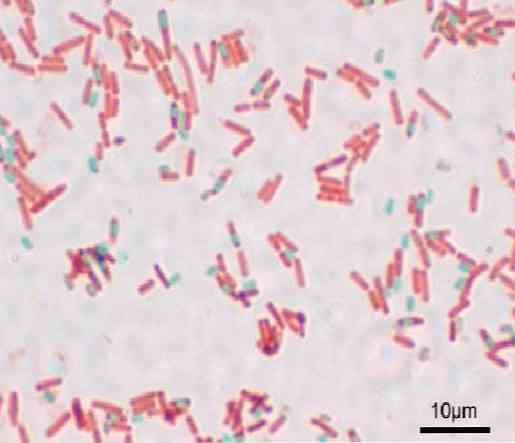
Katrs bacillus var radīt sporu. Preparāta krāsošanas laikā sporas var atrast bacillus (endospore) vai ārpus tās (exospore). Ar parastajām krāsošanas metodēm baktērijām - piemēram, Grama krāsai - sporas paliek bezkrāsainas.
Pašlaik ir vairākas krāsošanas metodes, kas spēj šķērsot sporas biezu struktūru, lai to krāsotu. Šīs metodes ir ļoti dažādas; starp tiem var minēt Dorner tehniku, Möeller traipu un Shaeffer-Fulton metodiku, kas pazīstama arī kā Wirtz-Conklin..
No visām minētajām metodēm Shaeffer-Fulton metodoloģija ir visbiežāk izmantota parastajās laboratorijās. Tā nosaukums ir divus mikrobiologus, kas 1930. gadā radīja krāsu: Alicia Shaeffer un MacDonald Fulton. Tomēr dažreiz šo metodi sauc par Wirtz-Conklin par godu diviem bakteriologiem no 1900. gadiem.
Indekss
- 1 Fonds
- 2 Sporas krāsošanas metodes
- 2.1. Dornera tehnika
- 2.2. Modificēta Dornera tehnika
- 2.3 Shaeffer-Fulton vai Wirtz-Conklin tehnika
- 2.4 Möeller tehnika
- 2.5. Modificēta Möeller tehnika bez siltuma
- 3 Lietojumi
- 3.1 Piemēri
- 4 Atsauces
Fonds
Sporas netīra ar parastām krāsām, jo tām ir ļoti bieza siena. Sporu sarežģītais sastāvs novērš lielāko krāsu nokļūšanu.
Ja sporas tiek pētītas no ārpuses uz iekšpusi, seko šādi slāņi: pirmkārt, eksosporijs, kas ir plānākais ārējais slānis, ko veido glikoproteīni..
Tad nāk kutikula, kas nodrošina izturību pret augstām temperatūrām, kam seko garoza, kas sastāv no peptidoglikāna. Tad ir pamatnes siena, kas aizsargā protoplastu.
Spora ir dehidrēta struktūra, kas satur 15% kalcija un dipikolīnskābes. Tāpēc vairums sporu krāsošanas paņēmienu balstās uz siltuma pielietošanu, lai krāsa varētu iekļūt biezā struktūrā.
Kad sporas ir krāsotas, tas nevar novērst krāsu. Shaeffer-Fulton tehnikā malahīta zaļš iekļūst veģetatīvajās šūnās un, uzklājot siltumu, iekļūst endosporā un arī eksosporās..
Mazgājot ar ūdeni, krāsu noņem no veģetatīvās šūnas. Tas notiek tāpēc, ka zaļā malahīta krāsviela ir nedaudz pamata, tāpēc tā vāji saistās ar veģetatīvo šūnu.
No otras puses, tas nevar izkļūt no sporas un visbeidzot, kontrastē bacillus ar safranīnu. Šis pamats ir derīgs pārējām metodēm, kurās notiek kaut kas līdzīgs.
Sporas krāsošanas metodes
Lai sporas kļūtu traipu, jums ir jābūt tīras kultūras aizdomās turētajam celmam, kuru vēlaties mācīties.
Kultūru 24 stundas pakļauj ekstremālām temperatūrām, lai stimulētu mikroorganismu sporulēšanos. Šim nolūkam kultūru var ievietot cepeškrāsnī 44 ° C temperatūrā vai ledusskapī (8 ° C) 24 vai 48 stundas.
Ja minētajās temperatūrās paliek pārāk daudz laika, tiks novērotas tikai eksosporas, jo visi endospori būs atstājuši bacillus.
Beidzot, uz tīra slaida jānovieto daži pilieni sterila fizioloģiskā šķīduma. Tad tiek ņemta neliela daļa kultūraugu un tiek veikta smalka izplatība.
Pēc tam to atstāj nožūt, tā tiek piestiprināta pie karstuma, un tā tiek krāsota ar dažām tālāk aprakstītajām metodēm:
Dornera tehnika
1 - Testa mēģenē sagatavo koncentrētu sporulēta mikroorganisma suspensiju destilētā ūdenī un pievieno vienādu tilpumu filtrētā Kinyoun fenola fuksīna..
2 - Novietojiet mēģeni vannā ar verdošu ūdeni 5 līdz 10 minūtes.
3- Uz tīras slaida iepiliniet iepriekšējās suspensijas pilienu ar 10% nigrosīna ūdens šķīduma pilienu, vārītu un filtrētu.
4- Paplašiniet un ātri izžāvējiet ar vieglu siltumu.
5. Pārbaudīt ar 100X mērķi (iegremdēšana).
Sporas traipina un baktēriju šūnas ir gandrīz bezkrāsainas pret tumši pelēku fonu.
Modificēta Dornera tehnika
1- Sporulēta mikroorganisma suspensija tiek uzklāta uz slaida un piestiprināta pie siltuma.
2- Paraugu pārklāj ar filtrpapīra sloksni, kurai pievieno fenīnskābes fuksīnu. Krāsu 5 līdz 7 minūtes karsē ar Bunsen degļa liesmu, līdz rodas tvaiku izdalīšanās. Tad papīrs tiek noņemts.
3 - Nomazgājiet preparātu ar ūdeni un pēc tam nosusiniet ar absorbējošu papīru.
4. Uzklājiet uztriepi ar plānu 10% nigrosīna plēvi, izmantojot otru slaidu, lai izplatītu nigrosīnu vai adatu..
Sporas un baktēriju krāsas ir tādas pašas, kā aprakstīts iepriekš.
Shaeffer-Fulton vai Wirtz-Conklin tehnika
1 - Uzlieciet plānu šķīvi ar sporulēta mikroorganisma suspensiju uz slaida un piestipriniet to siltumam.
2. Pārklājiet slaidu ar 5% malahīta zaļo ūdens šķīdumu (uz papīra var ievietot filtrpapīru).
3. Karsējiet Bunsen degļa liesmu, lai izplūst tvaiks un noņemtu liesmu. Atkārtojiet darbību 6-10 minūtes. Ja procedūras laikā malahīta zaļais šķīdums iztvaiko pārāk daudz, var pievienot vairāk.
4- Izņemiet filtrpapīru (ja tas ir ievietots) un nomazgājiet ar ūdeni.
5. Pārklājiet slaidu ar 0,5% safranīna ūdens šķīdumu 30 sekundes (daži metodes varianti izmanto 0,1% ūdens safranīnu un atstāj to 3 minūtes)..
Ar šo metodi sporas ir zaļas un bacīles ir sarkanas.
Tam ir trūkums, ka jauno kultūru endosporas nav traipi labi, jo tie izskatās ļoti skaidri vai bezkrāsaini. Lai to novērstu, ieteicams izmantot 48 stundu inkubācijas kultūras.
Möeller tehnika
1. Uzklājiet uztriepes ar hloroformu 2 minūtes.
2- Izmetiet hloroformu.
3 - 5 minūtes pārklāj ar 5% hromskābi.
4 - Mazgāt ar destilētu ūdeni
5- Loksne ir pārklāta ar fuksīna-fenola karpu un pakļauta Bunsen degļa liesmai, kamēr tvaiki izplūst; tad tas tiek izņemts no liesmas uz brīdi. Darbību atkārto, līdz tas sasniedz 10 minūtes.
6- Mazgāt ar ūdeni.
7 - Izmantojiet paskābinātu etanolu (sālsskābes alkoholu), lai nokrāsotu. Tas paliek 20 vai 30 sekundes.
8- Mazgāt ar destilētu ūdeni.
9 - 5 minūšu laikā pret loksnes pārklāšanu ar metilēnzilu.
10 - Mazgāt ar destilētu ūdeni.
11- Tas tiek atstāts nožūt un paraugs tiek uzņemts ar mikroskopu.
Sporas izskatās sarkanās un zilās bacilās. Svarīgi nav ieelpot tvaikus, jo tie ir toksiski un ilgtermiņā tie var būt kancerogēni.
Modificēta Möeller tehnika bez siltuma
2007. gadā Hayama un viņa līdzstrādnieki izveidoja Möeller tehnikas modifikāciju. Viņi noņēma krāsojuma sildīšanas pakāpi un aizstāja to ar 2 pilieniem Tergitol 7 virsmaktīvās vielas katram 10 ml fuksīna-fenola karbolīda šķīdumam. Tādi paši rezultāti tika iegūti.
Lietojumi
Sporu krāsošana sniedz ļoti vērtīgu un noderīgu informāciju patogēna identificēšanai, jo tās klātbūtne, tās forma, vieta bacilā un spēja deformēt veģetatīvo šūnu ir dati, kas var vadīt sugu. iesaistīti noteiktā dzimuma ietvaros.
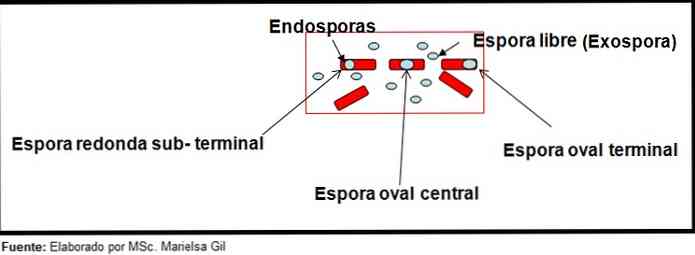
Šajā kontekstā ir vērts pieminēt, ka sporas var būt apaļas vai ovālas, tās var atrasties centrā vai arī paracentrālā, subterminālā vai terminālā stāvoklī..
Piemēri
- Clostridium difficile izveido ovālu sporu gala pozīcijā, kas deformē bacillus.
- Sporas Clostridium tertium Tas ir ovāls, deformē bacillus un atrodas gala līmenī.
- Endospore Clostridium tetani tas ir termināls un deformē bacillus, dodot drumstick izskatu.
- Sporas Clostridium botulinum, C. histolyticum, C. novy un C. septicum tie ir apaļas vai subterminālas ovālas un deformē bacillus.
- Endospore Clostridium sordelli tā atrodas centrālajā pozīcijā ar nelielu deformāciju.

Atsauces
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Priekšlikums vienkāršotai metodei baktēriju sporu krāsošanai, neizmantojot siltuma sekmīgu modifikāciju Moellera metodē. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Wikipedia dalībnieki. Moellera traipi. Vikipēdija, brīvā enciklopēdija. 2018. gada 3. novembris, 03:28 UTC. Pieejams: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Mikrobioloģisko metožu laboratorijas rokasgrāmata. Pamatzinātņu katedra Mikrobioloģijas akadēmija. Nacionālais politehniskais institūts.
- "Endospora." Vikipēdija, brīvā enciklopēdija. 25. februāris 2018, 10:20 UTC. 2019. gada 10. janvāris, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J un līdzstrādnieki. (2006). Ekstremaduras autonomā apgabala darbaspēks. Īpašā programma IV sējums. Redakcijas MAD. Sevilja – Spānija, 211. – 21. Lpp.
- Silva M, Garsija M, Corrales J, Ponce E. (2006. g.). Galīsijas veselības dienesta (SERGAS) speciālistu laboratorijas tehniķis. Priekšmeta specifiskais apjoms 2. Redakcijas MAD. Sevilja - Spānija, 79. – 80. Lpp.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobioloģiskā diagnoze. (5. izdevums). Argentīna, Redakcijas Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott mikrobioloģiskā diagnoze. 12 ed. Argentīna Panamericana S.A Redaktors


