Acinetobacter baumannii īpašības, morfoloģija, vielmaiņa
Acinetobacter baumannii Tā ir gramnegatīva baktērija, kas pieder pie pseudomonas kārtas. Visā taksonomijas vēsturē tā atrodas ģimenēs Micrococcus, Moraksella, Alcaligenes, Mirococcuscalco-aceticus, Herellea un Achromobacter, 1968. gadā, līdz tas atradās pašreizējā žanrā.
A. baumannii Tā ir patogēna baktērija, kas tiek uzskatīta par sugu, kas visbiežāk ir saistīta ar tās ģints infekcijām. Viņa ir iesaistīta dažāda veida infekcijās, piemēram, septicēmijā, pneimonijā un meningītā..
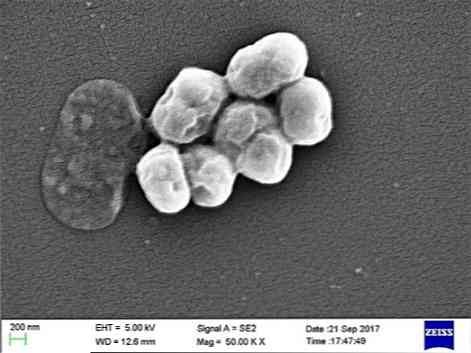
Tas ir oportūnistisks parazīts, kam ir būtiska saslimstība slimnīcās vai slimnīcās. Kā svarīgs infekcijas cēlonis ir norādīts transmisija ar mehānisko ventilāciju, īpaši intensīvās terapijas vienībās.
Neskatoties uz to, ka to uzskata par zemas kvalitātes patogēnu, tā spēj paaugstināt virulenci celmos, kas saistīti ar biežām infekcijām. Tam ir liela spēja attīstīt rezistenci un multirezistence pret antibiotikām.
Slimnīcās tas galvenokārt tiek nosūtīts, sazinoties ar darbiniekiem, izmantojot piesārņotus slimnīcas materiālus un arī pa gaisu īsos attālumos..
Pasaules Veselības organizācija ietver A. baumannii to rezistentu patogēnu sarakstā, par kuriem steidzami ir nepieciešamas jaunas antibiotikas, piešķirot 1. kategoriju ar kritisku prioritāti.
Indekss
- 1 Bioloģiskās īpašības
- 2 Morfoloģija
- 3 Metabolisms
- 4 Izturība pret antibiotikām
- 5 patoloģijas
- 6 Simptomi
- 7 Ārstēšana
- 8 Atsauces
Bioloģiskās īpašības
Visas sugas sugas Acinetobacter tie ir plaši izplatīti dažādās dabas nišās. A. baumannii tā var dabiski apdzīvot veselīgu cilvēku ādu, spējot kolonizēt gļotādas virsmas, kas ir nozīmīgs epidemioloģiskais rezervāts. Tomēr. \ T A. baumannii tas ir gandrīz ekskluzīvs slimnīcu vidē.
Šīm baktērijām trūkst flagella vai struktūras, ko izmanto kustībai. Tomēr tie sasniedz kustību, izmantojot struktūras, kas ļauj tām paplašināties un ievilkties, un ķīmiskie mehānismi, piemēram, lielas molekulmasas eksopolisaharīda plēves ekskrēcija aiz baktērijas..
A. baumannii var kolonizēt lielu skaitu dzīvu vai inertu vidi, un tai ir liela spēja izdzīvot uz mākslīgām virsmām ilgāku laiku.
Šī jauda, iespējams, ir saistīta ar tās spēju pretoties dehidratācijai, izmantot dažādus oglekļa avotus, izmantojot dažādus vielmaiņas ceļus, un iespēju veidot biofilmas. Šī iemesla dēļ tas ir bieži sastopams slimnīcu iekārtās, piemēram, katetros un mehāniskās ventilācijas ierīcēs.
Morfoloģija
A. baumannii ir kokcobaciliss, kas ir starpkociņi un nūjas. Tie ir no 1,5 līdz 2,5 ar 1 līdz 1,5 mikroniem, ja populācijas ir augšanas logaritmiskajā fāzē. Tie ir vairāk sfēriski, kad tie sasniedz stacionāru fāzi.
Metabolisms
Baktērija A. baumannii tas nav glikozes fermentors; tas ir stingrs aerobs, tas nozīmē, ka vielmaiņai nepieciešams skābeklis.
Ģints suga Acinetobacter tie ir vienīgie Moraxellaceae ģimenes locekļi, kuriem trūkst citohroma c oksidāžu, un tie oksidāžu testos dod negatīvus rezultātus..
A. baumannii tas aug temperatūrā, kas svārstās no 20 līdz 44ºC, optimālā temperatūra ir no 30 līdz 35ºC.
Izturība pret antibiotikām
Pastāvīga rezistences pret antibiotikām ģenerēšana ne tikai kavē inficēto slimību ārstēšanu un kontroli A. baumannii, tas veicina arī endēmisku un epidēmisku multiresistentu celmu atlasi.
Daži. \ T A. baumannii, kas veicina rezistenci pret antibiotikām:
- Klātbūtne β-laktamāzes nodrošina rezistenci pret b-laktāmiem.
- Specifisku enzīmu, piemēram, amoniglukozīda-3’-fosfotransferāzes VI, iegūšana inaktivē amikacīnu..
- Oksacilināzes OXA-51 klātbūtne hidrolizē penicilīnus un karbapenemus.
- Reflux sūkņu klātbūtne un pārprodukcija, kas ir sūkņi, kas izslēdz mazas molekulas ārpus šūnas, kas iekļūst citoplazmā, tādējādi samazinot to jutību pret antibiotikām.
Biofilmas, ko rada A. baumannii tie maina mikroorganismu metabolismu, samazinot to jutību pret antibiotikām, kā arī nodrošina fizisku barjeru pret lielām molekulām un novērš baktēriju dehidratāciju..
Patoloģijas
A. baumannii kolonizē jaunu uzņēmēju, sazinoties ar inficētiem cilvēkiem vai ar piesārņotu medicīnisko aprīkojumu. Pirmkārt, šīs baktērijas pievienojas ādas un gļotādas virsmām. Lai pavairotu, tai ir jāpaliek antibiotiku un inhibitoru iedarbībai un šo virsmu apstākļiem.
Baktēriju skaita pieaugums gļotādas virsmās, jo īpaši slimnīcā, saskaroties ar intravaskulāriem katetriem vai endotrahas caurulēm, var veicināt elpošanas ceļu un asinsrites infekcijas risku..
Slimnīcās noslēgtā pneimonija ir visbiežāk sastopamā infekcija A. baumanii. Intensīvās terapijas vienībās parasti tiek iekļauti pacienti, kas saņem mehānisku palīdzību.
A. baumanii Tā ir radījusi arī lielas problēmas sakarā ar militārpersonu inficēšanos ar pēckara traumām, īpaši Irākā un Afganistānā. Konkrēti, osteomielīta un mīksto audu infekciju dēļ, kas var izraisīt nekrozi un celulītu.
Pastāv arī meningīta risks A. baumanii pacientiem, kas atgūstas no neiroķirurģijas.
Indivīdi, kas ir uzņēmīgi pret infekciju A. baumanii ietver tādas, kas iepriekš bijušas pakļautas antibiotiku lietošanai, lielām operācijām, apdegumiem, traumām, imūnsupresijai vai invazīvām medicīniskām ierīcēm, galvenokārt mehāniskajai ventilācijai, intensīvās terapijas vienībās..
Simptomi
Nav specifisku infekciju simptomu A. baumanii. Katrai no dažādajām šīs baktērijas izraisītajām infekcijām ir savi raksturīgie simptomi.
Parasti infekciju simptomi, kas var būt saistīti ar infekciju A. baumanii vai citas oportūnistiskas baktērijas Klebsiella pneumoniae un Streptococcus pneumoniae, var būt drudzis, drebuļi, izsitumi, sāpīga urinācija, steidzama nepieciešamība urinēt bieži, apjukums vai garīgi stāvokļi, slikta dūša, muskuļu sāpes, sāpes krūtīs un klepus.
Ārstēšana
Antibiotikas infekciju ārstēšanai A. baumannii tie ir ārkārtīgi ierobežoti, ņemot vērā to lielo spēju iegūt pretestības un daudzveidību. Tāpēc ir svarīgi noteikt katra celma jutību pret dažādām antibiotikām, lai nodrošinātu katras ārstēšanas efektivitāti.
Ņemot vērā rezistenci pret karbapenēmiem, tika izmantota polimiksīnu, īpaši kolistīna, lietošana, neskatoties uz relatīvi zemo rezistences indeksu un tā blakusparādībām nierēs..
Tomēr jau ir konstatēti kolistīnam rezistenti celmi. Kā alternatīvu rezistencei pret šīm antibiotikām ir izmantota kombinētā terapija.
Atsauces
- Bergogne-Bérézin, E. & Towner, K.J. Acinetobacter spp. kā nozokomiālie patogēni: mikrobioloģiskās, klīniskās un epidemioloģiskās īpašības. Clin Microbiol Rev, 9 (1996), pp. 148-165.
- Fournier, P.E., Richet, H. (2006). Epidemioloģija un kontrole Acinetobacter baumanii veselības aprūpes iestādēs. Klīniskās infekcijas slimības, 42: 692-9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii multiresistants: pašreizējā klīniskā situācija un jaunās perspektīvas Spānijas Vēstnesis ķīmijterapijas, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: epidemioloģija, pretmikrobu rezistence un ārstēšanas iespējas. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: cilvēku infekcijas, faktori, kas veicina patoģenēzi un dzīvnieku modeļus. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: veiksmīga patogēna rašanās. Klīniskās mikrobioloģijas apskats, 21 (3): 538-82.
- Vanegas-Mūnera, J.M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N.. Acinetobacter baumannii: klīniskā nozīme, rezistences mehānismi un diagnoze. CES Medicine Journal, 28 (2), 233-246.


