Elektronu jūru teorija Pamati, īpašības un trūkumi
The elektronu elektronu teorija Tā ir hipotēze, kas izskaidro ārkārtas ķīmisko parādību, kas notiek metāliskajās saites starp elementiem ar zemu elektronegativitāti. Runa ir par elektronu koplietošanu starp dažādiem atomiem, ko savieno metāla saites.
Elektroniskais blīvums starp šīm saitēm ir tāds, ka elektroni tiek pārcelti un veido "jūru", kur viņi brīvi pārvietojas. To var izteikt arī ar kvantu mehāniku: daži elektroni (parasti viens līdz septiņi uz vienu atomu) ir izvietoti orbitālēs ar vairākiem centriem, kas stiepjas pāri metāla virsmai.
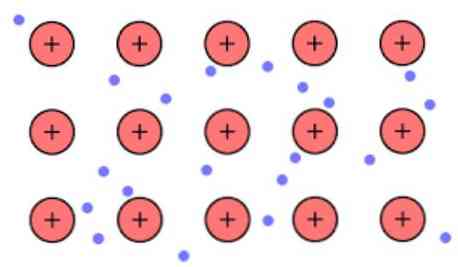
Arī elektroni saglabā noteiktu vietu metālā, lai gan elektroniskā mākoņa varbūtības sadalījumam ir augstāks blīvums ap dažiem konkrētiem atomiem. Tas ir saistīts ar to, ka, piemērojot konkrētu strāvu, tie parāda savu vadītspēju noteiktā virzienā.
Indekss
- 1 Elektronu jūras teorijas pamati
- 2 Rekvizīti
- 2.1. Novirze slāņu formā
- 2.2 Elektronu jūras teorija metāliskajos kristālos
- 3 Teorija trūkumi
- 4 Atsauces
Elektronu jūras teorijas pamati
Metāla elementiem ir liela tendence ziedot elektronus no sava pēdējā enerģijas līmeņa (valences slānis), jo to jonizācijas enerģija ir tik zema salīdzinājumā ar citiem elementiem..
Zinot to, katrs metāliskais elements var tikt uzskatīts par katjonu, kas saistīts ar tās pēdējā enerģijas līmeņa elektronu, kas būtu vairāk pakļauts ziedošanai..
Tā kā metālam ir liels skaits atomu, kas ir savstarpēji saistīti, jūs varat pieņemt, ka šis metāls veido metālu katjonu grupu, kas iegremdē sava veida valentelektronu jūrā, kam ir liels offshoring.
Ņemot vērā, ka starp katjonu (pozitīvo lādiņu) un elektronu (negatīvo lādiņu) pastāvošajiem elektrostatiskajiem piesaistes spēkiem ir cieši saistīti metālu atomi, tas iedomājas, ka valences elektroni tiek pārvērsti par elektrostatisku līmi, kas saglabājas saistoši metālu katjoniem.
Šādā veidā var secināt, ka, jo lielāks ir elektronu daudzums, kas atrodas metāla valences slānī, šāda veida elektrostatiskās līmes stiprums būs lielāks..
Rekvizīti
Elektronu jūras teorija piedāvā vienkāršu skaidrojumu metālisko sugu īpašībām, piemēram, pretestībai, vadītspējai, elastīgumam un mainīgumam, kas atšķiras no viena metāla uz otru.
Ir atklāts, ka metāliem pretestība ir saistīta ar to elektronu lielo pārvietošanu, kas rada ļoti augstu kohēzijas spēku starp atomiem, kas to veido.
Šādā veidā elastīgums ir pazīstams kā dažu materiālu spēja ļaut to struktūru deformēties, neizraisot pietiekami daudz pārtraukumu, ja tiek pakļauti dažiem spēkiem.
Offshoring slāņu veidā
Gan metāla elastīgumu, gan mainīgumu nosaka tas, ka valences elektroni tiek pārvietoti visos virzienos slāņu formā, kas izraisa to, ka ārējie spēki iedarbojas uz otru. izvairoties no metāla struktūras laušanas, bet pieļaujot tā deformāciju.
Tāpat arī pārvietoto elektronu pārvietošanās brīvība ļauj veikt elektriskās strāvas plūsmu, padarot metālus elektrības vadītspējas ziņā ļoti labā..
Turklāt šī elektronu brīvas kustības parādība ļauj nodot kinētisko enerģiju starp dažādiem metāla reģioniem, kas veicina siltuma pārnesi un izraisa metālu augstu siltuma vadītspēju..
Elektronu jūras teorija metāliskajos kristālos
Kristāli ir cietas vielas, kurām piemīt fizikālās un ķīmiskās īpašības, piemēram, blīvums, kausēšanas temperatūra un cietība, ko nosaka spēki, kas veido daļiņas, kas padara tās kopā..
Savā ziņā tiek uzskatīts, ka metāliskā tipa kristāliem ir visvienkāršākā struktūra, jo katrs kristāla tīkla "punkts" ir aizņemts ar paša metāla atomu..
Tādā pašā veidā ir konstatēts, ka parasti metāla kristālu struktūra ir kubiska un koncentrējas uz sejām vai ķermeni..
Tomēr šīs sugas var būt arī sešstūra formas, un tām ir samērā kompakts iepakojums, kas viņiem dod tik milzīgu blīvumu, kas ir raksturīgs.
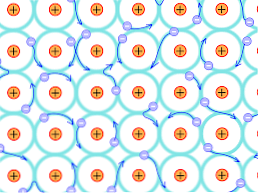
Šī strukturālā iemesla dēļ metāliskajos kristālos veidotās saites atšķiras no tām, kas rodas citos kristāla veidos. Elektroni, kas var veidot saites, tiek pārdalīti visā kristāliskajā struktūrā, kā paskaidrots iepriekš.
Teorijas trūkumi
Metāla atomos ir neliels daudzums valences elektronu proporcionāli to enerģētiskajam līmenim; tas ir, ir lielāks pieejamo enerģiju skaits nekā elektronu skaits.
Tas nozīmē, ka, tā kā ir spēcīga elektroniskā delokalizācija un arī daļēji piepildītas enerģijas joslas, elektroni var pārvietoties caur tīklenes struktūru, kad tie tiek pakļauti elektromagnētam, kas nāk no ārpuses, kā arī veido elektronu okeānu. kas atbalsta tīkla caurlaidību.
Tātad metālu savienība tiek interpretēta kā pozitīvi uzlādētu jonu konglomerāts, ko savieno elektronu jūra (negatīvi uzlādēts)..
Tomēr ir raksturlielumi, kas nav izskaidroti ar šo modeli, piemēram, dažu sakausējumu veidošanās starp metāliem ar īpašām kompozīcijām vai kolektīvo metāla savienojumu stabilitāte..
Šie trūkumi izskaidrojami ar kvantu mehāniku, jo gan šī teorija, gan daudzas citas pieejas ir izveidotas, pamatojoties uz vienkāršākā viena elektrona modeli, mēģinot pielietot daudz sarežģītākas daudzelektronisko atomu struktūras..
Atsauces
- Vikipēdija. (2018). Vikipēdija. Izgūti no en.wikipedia.org
- Holman, J. S. un Stone, P. (2001). Ķīmija Izgūti no books.google.co.ve
- Parkins, G. (2010). Metāla un metālu līmēšana. Izgūti no books.google.co.ve
- Rohrers, G. S. (2001). Kristālu materiālu struktūra un saistīšana. Izgūti no books.google.co.ve
- Ibach, H. un Lüth, H. (2009). Cietvielu fizika: Ievads materiālu zinātnes principos. Izgūti no books.google.co.ve


