Nātrija sulfīda formulas, lietošanas veidi, riski
The nātrija sulfīds (Na2S) ir kristāliska cietviela no dzeltenas līdz ķieģeļu sarkanai. Dabā tas ir sastopams dažādās hidratācijas pakāpēs, kas ir visizplatītākais nātrija sulfīda nehidrāts (Na2S · 9H2O)..
Tie ir ūdenī šķīstoši sāļi, kas nodrošina stipri sārmainus šķīdumus. Ja tie ir pakļauti mitram gaisam, tie absorbē mitrumu no gaisa, kas var spontāni uzsildīties un izraisīt aizdegšanos tuvumā esošiem degošiem materiāliem. Tāpat, saskaroties ar mitru gaisu, tie izstaro ūdeņraža sulfīdu, kas smaržo kā sapuvušas olas.

Tie ir spēcīgi reducētāji. Šīs vielas var būt bīstamas videi, jo īpaši ūdens organismiem.
Nātrija monosulfīds ir komerciāli pieejams pārslu veidā, kas satur 60-62% Na2S ...
- Formulas

- CAS: 1313-82-2 Nātrija sulfīds (bezūdens)
- CAS: 1313-84-4 Nātrija sulfīds (nehidratēts)
2D struktūra
3D struktūra
Nātrija sulfīda raksturojums
Fizikālās un ķīmiskās īpašības

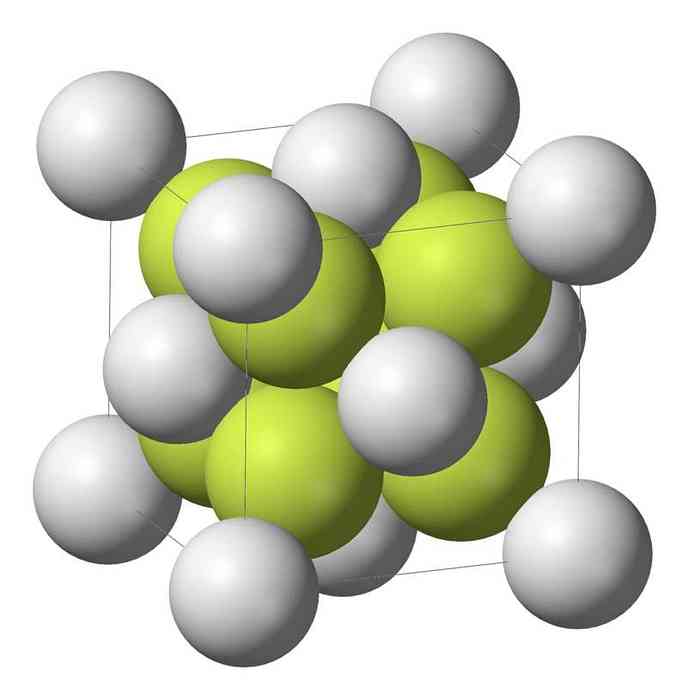
Nātrija monosulfīds (Na2S) kristalizējas ar antifluorīta struktūru, kurā katru S atomu ieskauj 8 Na atomu kubs un katrs Na atoms ar 4 S atomu tetraedru..
Uzliesmojamība
Vienīgais viegli uzliesmojošs loceklis neorganisko sulfīdu grupā ir sērūdeņradis. Tomēr daži citi neorganiskie sulfīdi, piemēram, nātrija sulfīds, var spontāni uzsildīties un pat aizdegties, ja tie ir pakļauti mitrumam..
Ugunsgrēka gadījumā nātrija sulfīds izdala sēra dioksīda gāzes vai tvaikus, kas ir kairinoši vai toksiski.
Reaktivitāte
- Neorganiskie sulfīdi parasti ir bāziski (daži ir stipri bāziski un tāpēc nesaderīgi ar skābēm).
- Daudzi no šiem savienojumiem ir reducētāji (tie enerģiski reaģē ar oksidētājiem)..
- Vienkārši sulfīdu sāļi (piemēram, nātrijs, kālija un amonija sulfīds) enerģiski reaģē ar skābēm, lai atbrīvotu ļoti toksiskas un uzliesmojošas sērūdeņraža gāzes..
- Nātrija sulfīds ir uzliesmojošs. Var ātri eksplodēt, ja tas tiek ātri uzsildīts, vai hit.
- Sildot līdz sadalīšanās procesam, tas izdala nātrija oksīda un sēra oksīdu toksiskus tvaikus.
- Reaģē ar oglekli ar ogli, diazonija sāļiem, N, N-dihlormetilīnu, stipriem oksidētājiem un ūdeni.
Toksicitāte
Daudzi neorganisko sulfīdu grupas dalībnieki uzvedas kā spēcīgas bāzes un var izraisīt smagus apdegumus, kad tie nonāk saskarē ar ādu..
Šis īpašums ir atkarīgs no tā šķīdības. Nešķīstošākie neorganiskie sulfīdi (piemēram, dzīvsudraba (II) sulfīds un kadmija sulfīds) nav kodīgi..
Nātrija sulfīdam ir oktanola / ūdens sadalījuma koeficienta (Pow) barotne (-3,5). Šo vērtību izmanto kā vielas šķīdības (un biokoncentrācijas) mērījumu dzīvnieku taukaudos (īpaši ūdens dzīvniekiem)..
Nātrija sulfīdu uzskata par bīstamu videi, jo īpaši ūdens organismiem.
Lietojumi
Mājās nātrija sulfīds tiek izmantots, lai atklātu caurules, mājsaimniecības tīrīšanas līdzekļus (krāsns, vannas istaba), matu iztaisnotājus, trauku ziepes un auto gaisa spilvenus.
Rūpniecībā to izmanto tīrīšanas līdzekļos, cementā un kā citu ķīmisko produktu priekšteci.
Klīniskā iedarbība
Nātrija sulfīda iedarbība ir izplatīta gan attīstītajās valstīs, gan mazāk attīstītajās valstīs gan rūpniecībā, gan mājās. Šīs kodīgās vielas atrodas vairākos mājsaimniecības produktos zemā koncentrācijā.
Attīstītajās valstīs nopietnas sekas ir reti. Tie rodas galvenokārt tādēļ, ka pieaugušais cilvēks ir apzināti uzņemis šo vielu. Tomēr jaunattīstības valstīs nopietnākas sekas ir biežākas.
Sārmainas kodīgas vielas izraisa nekrozi, ko izraisa sašķidrināšana. Saponificēt taukus šūnu membrānā, iznīcinot šūnu un ļaujot dziļi iekļūt gļotādu audos..
Iekšķīga iedarbība
Sākotnējais iekaisums rodas kuņģa-zarnu trakta audos, kam seko audu nekroze (ar iespējamu perforāciju), pēc tam granulēšana un galu galā stenozes veidošanās..
Pacientiem, kuriem ir viegla norīšana, rodas orofarīnijas, barības vada vai kuņģa kairinājums vai I pakāpes apdegumi (virspusēja hiperēmija un tūska)..
Pacientiem ar mērenu intoksikāciju var rasties II pakāpes apdegumi (virspusēji blisteri, erozijas un čūlas) ar iespējamu turpmāku stenozes veidošanos (īpaši barības vada)..
Dažiem pacientiem (īpaši maziem bērniem) augšējā elpceļos var attīstīties tūska.
Pacientiem ar smagu intoksikāciju, ja norīts, var rasties dziļi apdegumi un kuņģa-zarnu trakta gļotādas nekroze ar komplikācijām, tādām kā: perforācija (barības vada, kuņģa, reti divpadsmitpirkstu zarnas), fistula veidošanās (tracheoesofagāls, aortoesophageal) un kuņģa-zarnu trakta asiņošana..
Tās var attīstīties: hipotensija, tahikardija, tahipnija, stingrības veidošanās (galvenokārt barības vada), barības vada karcinoma un augšējo elpceļu tūska (kas ir bieži un bieži dzīvībai bīstama)..
Smaga saindēšanās parasti aprobežojas ar apzinātu uzņemšanu pieaugušajiem.
Iedarbība ieelpojot
Viegla iedarbība var izraisīt klepu un bronhu spazmu.
Smaga ieelpošana var izraisīt augšējo elpceļu tūsku, apdegumus, stridoru un reti - akūtu plaušu bojājumu..
Acu iedarbība
Tas var izraisīt smagu konjunktīvas kairinājumu un ķīmisko slimību, radzenes epitēlija defektus, limbisku išēmiju, pastāvīgus redzes zudumus un smagus perforācijas gadījumus..
Iedarbība caur ādu
Viegla iedarbība izraisa kairinājumu un daļēju biezuma apdegumus. Pacientiem ar smagiem apdegumiem vai šoku var attīstīties metaboliskā acidoze.
Ilgstoša iedarbība vai augstas koncentrācijas produkti var izraisīt kopējo biezuma apdegumus.
Drošība un riski
Ķīmisko vielu klasifikācijas un marķēšanas globāli harmonizētās sistēmas bīstamības paziņojumi (SGA)
Ķīmisko vielu klasifikācijas un marķēšanas globālā harmonizētā sistēma (SGA) ir starptautiski atzīta sistēma, ko izveidojusi Apvienoto Nāciju Organizācija un kura mērķis ir aizstāt dažādus klasifikācijas un marķēšanas standartus, ko izmanto dažādās valstīs, izmantojot konsekventus kritērijus visā pasaulē..
Bīstamības klases (un to atbilstošā GHS nodaļa), klasifikācijas un marķēšanas standarti un ieteikumi par nātrija sulfīdu ir šādi (Eiropas Ķimikāliju aģentūra, 2017, Apvienoto Nāciju Organizācija, 2015, PubChem, 2017):







Atsauces
- Benjah-bmm27, (2006). Fluorīta vienības šūnu-3D jonu [attēls] Saturs iegūts no: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Saturs iegūts no: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktūra 1313-82-2 - nātrija sulfīds [image] Saturs iegūts no: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktūra 1313-84-4 - nātrija sulfīds [image] Saturs iegūts no: chem.nlm.nih.gov.
- Eiropas Ķimikāliju aģentūra (ECHA). (2017). Klasifikācijas un marķējuma kopsavilkums.
- Saskaņota klasifikācija - Regulas (EK) Nr. 1272/2008 VI pielikums (CLP regula). Nātrija sulfīds. Saturs saņemts 2017. gada 16. janvārī no: echa.europa.eu.
- Eiropas Ķimikāliju aģentūra (ECHA). (2017). Klasifikācijas un marķējuma kopsavilkums.
- Paziņotā klasifikācija un marķēšana. Nātrija sulfīds, hidratēts. Saturs saņemts 2017. gada 16. janvārī no: echa.europa.eu.
- Bīstamo vielu datu banka (HSDB). TOXNET (2017). Nātrija sulfīds. Bethesda, MD, ES: Nacionālā medicīnas bibliotēka. Saturs iegūts no: toxnet.nlm.nih.gov.
- Lange, L., un Triebel, W. (2000). Sulfīdi, polisulfīdi un sulfāni. Ullmana rūpnieciskās ķīmijas enciklopēdijā. Wiley-VCH Verlag GmbH & Co. KGaA. Izgūti no dx.doi.org.
- Apvienoto Nāciju Organizācija (2015). Globālā harmonizētā ķīmisko produktu klasifikācijas un marķēšanas sistēma (SGA) Sestais pārskatītais izdevums. Ņujorka, Amerikas Savienotās Valstis: ANO publikācija. Saturs iegūts no: unece.org.
- Nacionālais biotehnoloģijas informācijas centrs. PubChem Compound datu bāze. (2016). Nātrija sulfīda enneahidrāts - PubChem struktūra [image] Saturs iegūts no: pubchem.ncbi.nlm.nih.gov.
- Nacionālais biotehnoloģijas informācijas centrs. PubChem Compound datu bāze. (2017). Nātrija monosulfīds. Bethesda, MD, ES: Nacionālā medicīnas bibliotēka. Saturs iegūts no: pubchem.ncbi.nlm.nih.gov.
- Nacionālais biotehnoloģijas informācijas centrs. PubChem Compound datu bāze. (2017). Nātrija sulfīda enneahidrāts. Bethesda, MD, ES: Nacionālā medicīnas bibliotēka. Saturs iegūts no: pubchem.ncbi.nlm.nih.gov.
- Valsts okeāna un atmosfēras pārvalde (NOAA). CAMEO Chemicals. (2017). Ķīmisko datu lapa. Bezūdens nātrija sulfīds. Sudraba pavasaris, MD. ES; Saturs iegūts no: cameochemicals.noaa.gov.
- Valsts okeāna un atmosfēras pārvalde (NOAA). CAMEO Chemicals. (2017). Reaktīvās grupas datu lapa. Neorganiskie sulfīdi. Sudraba pavasaris, MD. ES; Saturs iegūts no: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Saturs iegūts no: wikipedia.org.
- PubChem, (2016). Nātrija monosulfīds [image] Saturs iegūts no: puchem.nlm.nih.gov.
- PubChem, (2016). Nātrija sulfīda enneahidrāts [image] Saturs iegūts no: puchem.nlm.nih.gov.
- Vikipēdija. (2017). Oktanola un ūdens sadalījuma koeficients. Ielādēts 2017. gada 17. janvārī no: wikipedia.org.
- Vikipēdija. (2017). Nātrija sulfīds. Ielādēts 2017. gada 17. janvārī no: wikipedia.org.


