Šķīdinātās īpašības, atšķirības ar šķīdinātāju un šķīdinātāju, piemēri
The šķīdinātājs, risinājumā,tā ir viela, kas šķīdinātājā izšķīst. Parasti šķīdinātājs ir mazāks, un tas var būt ciets, šķidrs vai gāzveida. Gluži pretēji, šķīdinātājs ir šķīduma sastāvdaļa, kas ir vairāk.
Piemēram, sālsūdenī sāls ir šķīdinātājs un ūdens ir šķīdinātājs. Tomēr ne visi šķīdinātāji ir cieti vai šķīdinātāji ir šķidri.

Šajā ziņā ir vairākas iespējamās šķīdinātāju un šķīdinātāju kombinācijas: gāze šķidrumā, gāze cietā vielā, šķidrums šķidrumā, šķidrums cietā vielā, cietā viela šķidrā vai cietā vielā cietā vielā..
Lai atpazītu, kurš šķīdums ir šķīdumā, jāņem vērā divi aspekti. Pirmkārt, šķīdinātājs ir viela, kas ir mazākā proporcijā. Turklāt tas ir tāds, kas maina tā fizisko stāvokli (cieto, šķidro vai gāzveida), kad tas ir integrēts šķīdumā.
Indekss
- 1 Šķīdumi, šķīdinātāji un šķīdinātāji
- 2 Šķīdinātāja definīcija
- 3 Raksturojums
- 3.1. Šķīdība
- 3.2 Temperatūra
- 3.3 Šķīduma piesātinājums
- 3.4 Spiediens
- 3.5. Polaritāte
- 4 Atšķirības starp šķīdinātāju un šķīdinātāju
- 5 Šķīdinātāju piemēri
- 5.1. Solutos gāzveida stāvoklī
- 5.2. Solutos cietā stāvoklī
- 5.3. Solutos šķidrā stāvoklī
- 5.4. Solutos, ko var izmantot mājās
- 6 Atsauces
Šķīdumi, šķīdinātāji un šķīdinātāji
Ķīmijā ir viendabīgi maisījumi, kas ir tie, kuru sastāvdaļas ir sadalītas vienādās proporcijās ar to saturu. Viens no visbiežāk sastopamajiem homogēnu maisījumu veidiem ir šķīdumi, kas ir stabili homogēni divu vai vairāku vielu maisījumi, ja šķīdinātājs izšķīst šķīdinātājā..
Šķīdumi, šķīdinātāji un šķīdinātāji tiek novēroti ikdienas situācijās un diapazonā, kas dažādās nozarēs atšķiras. Šīs vielas, kas veidojas no maisījumiem, ir pētījuma priekšmeti, ņemot vērā to raksturīgās īpašības un spēkus un / vai atrakcijas starp tām..
Šķīdinātāja definīcija
Kā minēts iepriekš, šķīdinātājs ir viela, kas izšķīst citā, ko sauc par šķīdinātāju.
Parasti šķīdinātājam ir mazāka proporcija, un tā var rasties jebkurā no trijām vielām. Ja tiek piedāvāts risinājums starp divām vielām, kas atrodas vienā fāzē, tad to, kā izvēlēties, kas ir šķīdinātājs un kas ir šķīdinātājs, izmanto, izvēloties mazāku daļu..
Šķīdinātāja izšķīdināšanas spēju regulēs šķīdība. Šķīdinātāja temperatūra arī ir noteicošais faktors, lai uzzinātu, vai ir iespējams veidot šķīdumu vai tā nav, jo jo augstāka ir šķīdinātāja temperatūra, jo lielāks ir šķīdinātāja daudzums, ko var izšķīdināt..
Ir vielas, ko sauc par virsmaktīvajām vielām, kas augstākā temperatūrā kļūst mazāk šķīstošas, bet tās ir izņēmumi un pilda konkrētas lomas.
Process, kurā šķīdinātājs mijiedarbojas ar šķīdinātāju, lai veidotu šķīdumu, tiek definēts kā solvācija, un tas ietver obligāciju un ūdeņraža tiltu veidošanos, papildus Van der Waals spēku atrakcijām..
Funkcijas
Šķīdinātāji sastāv no ļoti daudzām ķīmiskām vielām dažādās valstīs, tām ir atšķirīgas izšķīdināšanas spējas un tām ir daudzas īpašības, kurām ir svarīga loma viendabīgu maisījumu veidošanā. Daži no solātu galvenajiem raksturlielumiem ir šādi:
Šķīdība
Šķīdība ir savienojuma spēja izšķīst citā vielā. Šai spējai ir cieša saikne ar sajaucamību, kas ir šķidruma spēja sajaukt ar konkrētu; Ja jūs nevarat pievienoties, tas ir nesavietojamība.
Maisījumam ir vairāk nekā noteikts skaitlis, tāpēc var teikt, ka viena viela ir pilnīgi, daļēji vai nesajaucama citā..
Šķīdinātāja šķīstošā īpašība, savukārt, ir atkarīga no citiem faktoriem, kas var palielināt vai samazināt šo jaudu sakarā ar to ietekmi uz starpmolekulāro spēku līdzsvaru, kas rodas starp šķīdinātāju un šķīdinātāju..
Vēl mazāk sagaidāmās iezīmes, piemēram, šķīdinātāja piliena lielums vai kārtība kristāla struktūrā, var ietekmēt to spēju izšķīdināt.
Temperatūra
Sistēmas temperatūra, kurā šķīdinātājs izšķīst, var ietekmēt tā šķīdību: vairumam cieto vielu un šķidrumu tas palielina tā izšķīdināšanas spēju atbilstoši temperatūras pieaugumam..
Savukārt gāzēs ir novērota sarežģīta uzvedība, kas parādās kā zemāka šķīdība ūdenī augstākās temperatūrās, bet lielāka - organiskajos šķīdinātājos..
Šķīduma piesātinājums
To sauc par šķīduma piesātinājumu līdz tādam līmenim, kādā šķīdums izšķīdina šķīdinātāju, ko sauc par piesātinātu šķīdumu, lai izšķīdinātu pēc iespējas vairāk šķīdinātāju. No šī brīža pievienotā šķīdinātāja nogulsnes kā pārpalikums izmantotā konteinera apakšā; pirms tam šķīdumu sauc par nepiesātināto.
Ir iespējams iziet piesātinājuma punktu un turpināt izšķīdināt šķīdinātāju, bet tas prasa temperatūras paaugstināšanos. Šķīdumu, kas satur lieko šķīdumu un kas ir sakarsēts, sauc par pārmērīgu šķīdumu.
Spiediens
Spiediena izmaiņas parasti neietekmē cietvielu un šķidrumu šķīdību, izņemot dažus izņēmuma gadījumus (kalcija sulfāta uzkrāšanās naftas caurulēs), bet gāzēs tas ir noteicošais faktors to spējas izšķīst..
Faktiski gāzes šķīdība šķīdinātājā ir tieši proporcionāla minētā gāzes daļējam spiedienam uz minētā šķīdinātāja.
Polaritāte
Šķīdinātāja polaritāte ir būtiska, novērtējot tā izšķīdināšanas spēju; šķīdinātājs labāk izšķīdinās šķīdinātājā, kura ķīmiskā struktūra ir līdzīga tai, kāda tā ir.
Piemēram, ļoti polāriem vai hidrofilām vielām būs lielāka šķīdība ļoti polāros šķīdinātājos, kamēr tās praktiski nešķīst polārās vielas..
Līdzīgi, starpmolekulārajiem spēkiem ir svarīga loma solvācijā un vieglums, ar kādu šķīdinātājs var izšķīdināt šķīdinātāju: lielāki dipola-dipola spēki, ūdeņraža saites un citas saites, jo lielāks šķīdinātāja spējas izšķīst izšķīdina un veido šķīdumu.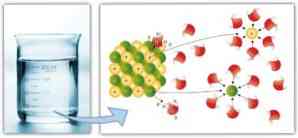
Atšķirības starp šķīdinātāju un šķīdinātāju
- Šķīdinātājs ir viela, kas izšķīst; šķīdinātājs ir šķīdinātāja (-u) izšķīdināšanas līdzeklis..
- Šķīdinātājs var būt cietā, šķidrā vai gāzes fāzē; šķīdinātājs parasti atrodas šķidrā fāzē, bet tas ir arī cietā un gāzveida.
- Šķīdinātāja šķīdība vairāk atkarīga no tādām īpašībām kā virsma; Šķīdinātāja ietilpība, cita starpā, ir atkarīga no polaritātes, temperatūras un spiediena.
- Šķīdinātājs parasti ir vēlamais komponents, kas ekstrahējams rūpnieciskajos procesos; Šķīdinātājs parasti nav vēlamais komponents un tiek izmests rūpnieciskos procesos.
Šķīdinātāju piemēri
- Cukurs ir cietas fāzes šķīduma piemērs, ko parasti izmanto ūdens saldināšanai.
- Heksānu var atrast parafīna vaskā, kas kalpo kā šķidra šķidra viela, kas padara šo cietu vairāk kalējamu.
- Oglekļa dioksīds ir gāze, kas pievienota dzērieniem, lai dotu tiem putekļus.
Solutos gāzes stāvoklī
Oglekļa dioksīds ūdenī (bezalkoholiskie dzērieni)
Oglekļa ūdens ir ūdens, kas satur oglekļa dioksīdu un ko ražo, izplūstot oglekļa dioksīdu zem spiediena.
Gāzēts minerālūdens ilgstoši notiek dabiski. Šie putojošie ūdeņi ir saistīti ar oglekļa dioksīda pārpalikumu ūdenstilpē, kas ir izšķīdis zem spiediena.
Viens no pazīstamākajiem šķīdinātāju piemēriem ir komerciālie bezalkoholiskie dzērieni, kas tiek kombinēti ar sīrupu.
Oglekļa dioksīda klātbūtne padara šos ūdeņus un bezalkoholiskos dzērienus apetīti un vizuāli pievilcīgākus.
Skābeklis un citas gāzes slāpeklī (gaisā)
Gaisa atmosfērā ir dažādu gāzu molekulas. Tas pamatā sastāv no 78% slāpekļa un aptuveni 21% skābekļa (šķīdinātāja). Turklāt tas satur gandrīz 1% argona un citu molekulu, bet ļoti mazos daudzumos.
Propāns butānā (gatavošanas gāze)
Šo kombināciju, kas pazīstama arī kā sašķidrinātā naftas gāze (LPG), sāka izmantot kopš 1860. gada kā mājsaimniecības degvielas avotu..
Kopš tā laika tā ir paplašinājusi savu ražošanu un patēriņu gan vietējai, gan rūpnieciskai izmantošanai. Tā kā abas gāzes ir ārkārtīgi bez smaržas un bīstamas, pievieno vielu, ko sauc par merkaptānu, kas padara iespējamu noplūdi..
Solutos cietā stāvoklī
Vara cinks (misiņš)
Tirdzniecības sakausējumu, kas pazīstams kā misiņš, veido cinks (no 5 līdz 40%), kas izšķīdināts vara. Cinks palīdz palielināt stiepes izturību. Šim sakausējumam var pievienot citus elementus, piemēram, alvu, dzelzi, alumīniju, niķeli un silīciju.
Jods alkoholā (joda tinktūra)
Vēl viens tautas pazīstamā šķīduma piemērs ir joda tinktūra. Šis šķīdums satur etilspirta jodu (no 44 līdz 50%). Joda tinktūra tiek izmantota kā antiseptisks līdzeklis.
Sāls ūdenī (jūras ūdens)
Jūras ūdens aptver vairāk nekā 70% no Zemes virsmas. Tas ir 96,5% ūdens, 2,5% sāļu un citu vielu mazāku daudzumu maisījums. Tas ietver neorganiskus un izšķīdušus organiskos materiālus, daļiņas un dažas atmosfēras gāzes.
Solutos šķidrā stāvoklī
Alkohols ūdenī (alkoholiskie dzērieni)
Etanols vai etilspirts (šķīdinātājs) no cukura fermentācijas tiek sajaukts ar ūdeni fiksētās proporcijās, lai iegūtu alkoholiskos dzērienus.
Šis savienojums organismā ir viegli sagremojams, bet tā pārpalikums var izraisīt nopietnu kaitējumu veselībai.
Ūdens gaisā (mitrums gaisā)
Ūdens gaisā ir pazīstams kā migla. To izraisa nelieli ūdens pilieni, kas ir suspendēti gaisā, un tas galvenokārt ir saistīts ar zemes dzesēšanu nakts laikā.
Šādā veidā šī dzesēšana izraisa apkārtējā gaisa temperatūras pazemināšanos. Tad parādās parādība, kad tajā saglabājas kondensēts ūdens.
Etiķskābe ūdenī (etiķis)
Etiķis ir šķidrums ar asu garšu, ko izmanto, lai pievienotu garšu vai saglabātu pārtiku. To pagatavo ar etiķskābes šķīdumu, kas sajaukts ar ūdeni.
Etiķskābes koncentrācija ir mainīga. Piemēram, destilētā etiķa īpatsvars ir no 5 līdz 8%..
Dzīvsudrabs sudrabā (amalgamas vai zobu pildījumi)
Amalgamas, ko izmanto zobu pildīšanai, veido 2% dzīvsudraba ar sakausējumu, kas darbojas kā šķīdinātājs. Šis sakausējums satur 70% sudraba. Jūs varat pievienot arī alvu, varu un cinku.
Solutos, ko var izmantot mājās
Cukurs ūdenī
Cukurs ir molekulārs un polārs savienojums, un tādā veidā tas spēj izšķīst ūdenī, kas ir arī polārais elements..
Cukura strukturēšanas veids izmainīs izšķīšanas procesu. Piemēram, ja cukurs ir gabalos, izšķīdināšanai būs nepieciešams vairāk laika nekā tad, ja tas ir graudos.
Daži eksperti uzskata, ka ūdens ar cukuru ir ļoti svarīgs enerģijas avots ķermenim. Ir bijuši pat pētījumi, kas atklāj šī risinājuma efektivitāti cilvēkiem, kas nodarbojas ar fizisko aktivitāti.
Cukurs miltos
Kūkas pagatavošanai parasti ir jāsagatavo cietās sastāvdaļas, tad pievienojiet šķidrumus.
Cukurs ir šķīdinātājs, kas piestiprināts pie miltiem, radot kūka bāzes maisījumu. Papildus šīm divām sastāvdaļām vēlāk tiek pievienotas citas, piemēram, olas, sviests vai vaniļa.
Šis šķīdinātājs ir ciets, un šajā gadījumā to sajauc ar šķīdinātāju, kas arī ir ciets. Iegūto bāzi var izmantot arī saldu maizes, cepumu, kūku, sūkļu kūku, mazu pudiņu un daudzu citu saldu ēdienu pagatavošanai..
Sulu pulveris ūdenī
Ir plašs pulverveida sulu klāsts, ko sagatavo, izšķīdinot šo elementu ūdenī. Šajā gadījumā šķīdinātājs ir sulas pulveris un šķīdinātājs ir ūdens.
Šķīdinātāja daudzumam jābūt lielākam par šķīdinātā šķīduma daudzumu, tāpēc parasti vienu vai divas ēdamkarotes sulas pulvera izšķīdina glāzē ūdens. Pat ir daži pulveri, kuru koncentrācija ir lielāka un jāizmanto mazāks daudzums.
Šīs sulas ir pazeminošas, jo tās norāda, ka sastāvdaļas, kuras tās ietver (kā, piemēram, konservanti, stabilizatori un saldinātāji) ir kaitīgi veselībai.
Hlora ūdenī
Viens veids, kā attīrīt ūdeni, ir hlora izmantošana ūdenī izšķīdinātā šķīdinātājā. Šis dezinfekcijas līdzeklis ir raksturīgs kā viens no visbiežāk izmantotajiem mikrobu iznīcināšanas veidiem, un ir ideāli ātri, ekonomiski un viegli nogādāt dzeramo ūdeni dzeramā ūdenī.
Hlora kā šķīduma šķīdums jāiekļauj ūdenī koncentrācijā, kas nepārsniedz 0,2 un 0,5 miligramus litrā.
Izmantojamam hlora daudzumam jābūt ļoti zemam, jo šī viela var būt ļoti toksiska, ja to lieto vai pakļauj daudziem daudzumiem.
Šī ūdens attīrīšanas metode ir pazīstama kā hlorēšana, un to var pielietot ekskursijas pa kalnu vidū vai apstrādāt ūdeni mājās, lai likvidētu baktērijas un mikrobus, kas atrodami caurulēs, caur kurām ūdens iet..
Krāsošana ūdenī
Ūdens ir universālākais šķīdinātājs, kas pastāv, un tas ir arī pamats, uz kura var izšķīst tādas vielas, kā krāsa.
Krāsa parasti izšķīst dažādu iemeslu dēļ. Visbiežāk ir atvieglot suku un citu krāsošanai izmantoto rīku tīrīšanu.
Ir daudz veidu gleznas; Tie, kas vislabāk izšķīst ūdenī, ir lateksa. Papildus tam, lai varētu labāk iztīrīt darbarīkus, pirms krāsošanas sākšanas krāsas atšķaidīšanas ūdens priekšrocība ir tā, ka tā garantēs labāku apdari uz krāsotas virsmas.
Piena pulveris ūdenī
Piena pulveris ir šķīdinātājs, ko veido piens, kas jau ir pasterizēts. Šā procesa mērķis ir nodrošināt, ka pienu ilgāk var uzglabāt labāk.
Šis šķīdinātājs izšķīst ūdenī un rada šķidru pienu, kas parasti tiek uzņemts brokastīs kopā ar kafiju vai dažādos preparātos.
Tāpat kā sulas pulvera gadījumā, atšķaidāmā piena daudzumam jābūt mazākam par ūdens daudzumu, kurā vēlaties pagatavot šķīdumu..
Mazgāšanas līdzeklis ūdenī
Mazgājot drēbes, tiek izmantoti šķidrie vai pulvera mazgāšanas līdzekļi. Tie tiek izšķīdināti ūdenī, veidojot šķīdumu, kas darbojas kā tekstilizstrādājumu dezinfekcijas līdzeklis un tīrītājs.
Šķīdinātāja daudzums, kas jāizmanto šajā šķīdumā, ir mainīgs atkarībā no mazgāšanas līdzekļa veida, tās pašas un tā sastāvdaļām..
Šķīdums, kas sastāv no mazgāšanas līdzekļa un ūdens, var būt ļoti piesārņojošs, ja tas nonāk saskarē ar ūdens izgāztuvēm, tāpēc ieteicams izmantot bioloģiski noārdāmus mazgāšanas līdzekļus, kas ļoti īsā laikā var kļūt degradēti un daudz mazāk ietekmēt vidi.
Želatīns
Želatīns ir cīpslu, saišu un dzīvnieku kaulu elements. Šis savienojums var būt pulverī vai loksnēs.
Abos gadījumos šis šķīdums jāizšķīdina karstā ūdenī, lai sasniegtu galīgo rezultātu: salds ēdiens, kas ideāli piemērots desertiem un ar daudziem veselības ieguvumiem.
Viens no šī savienojuma priekšrocībām ir tas, ka tas veicina ātru audu atjaunošanos un ir pretiekaisuma līdzeklis. Turklāt tam ir liels olbaltumvielu daudzums un tai ir svarīga loma imūnsistēmas nostiprināšanā.
Ēdot nelielu ikdienas želatīna daudzumu, var atjaunot locītavas un tādējādi paredzēt osteoporozes rašanos.
Šokolāde pienā
Šokolāde ir elements, ko veido kakao un kakao sviesta maisījums. Šis pārtikas produkts darbojas kā šķīdinātājs, sajaucot ar pienu, lai sagatavotu to, kas pazīstams kā karstā šokolāde.
Šim preparātam tiek uzkarsēts vēlamais piena daudzums un pievienota šokolāde gabalos, pulverī vai šķidrumā, pastāvīgi maisot.
Lai šis šķīdinātājs izšķīst vislabākajā iespējamā veidā un izvairītos no gabaliem, ir nepieciešams pārspēt maisījumu bez pauzes.
Kakao pulveris ūdenī
Jūs varat arī pagatavot karstu šokolādi, izmantojot kakao pulveri. Šo šķīdinātāju veido tikai kakao pulvera masa. Atšķirībā no šokolādes kakao nesatur šī augļa sviestu.
Kakao var pilnīgi izšķīdināt ūdenī, lai radītu šokolādes aromātu. Šādos gadījumos ir svarīgi saldināt maisījumu ar cukuru, medu vai kādu saldinātāju; pretējā gadījumā rezultāts būs ļoti rūgts.
Atsauces
- Lambert, N. un Mohammed, M. (1993). Ķīmija CXC. Oxford: Heinemann.
- Steen, D. P. (2008). Oglekļa dioksīds, karbonizācija un pildīšanas tehnoloģijas principi. D. P. Steen, Philip un P. R. Ashurst (redaktori), gāzētie bezalkoholiskie dzērieni: preparāts un ražošana, pp. 112-143. Oxford: Blackwell Publishing.
- Kas ir gaisā? (s / f). UCAR Zinātnes izglītības centrs. Saturs saņemts 2017. gada 17. oktobrī no eo.ucar.edu
- Sašķidrinātā naftas gāze. (2013. gada 12. jūlijs). Encyclopædia Britannica.
Saturs saņemts 2017. gada 16. oktobrī no britannica.com - Lytle, D. A. un Schock, M. R. (1996). Stagnācijas laiks, sastāvs, PH un ortofosfāta efekti uz metālu izskalošanos no misiņa. Ohaio: ASV Vides aizsardzības aģentūra.
- Crabwee, T. D .; Pelletier, S. J. un Pruett, T. L. (2001). Ķirurģiskā antisepsija S. S. Block (redaktors), dezinfekcija, sterilizācija un saglabāšana, pp. 919-934. Filadelfija: Lippincott Williams & Wilkins.
- Birne, R. H. et al (2017, 07. jūnijs). Jūras ūdens. Encyclopædia Britannica. Saturs iegūts 2017. gada 17. oktobrī no britannica.com
- Plutowska B. un Wardencki, W. (2012). Alkoholisko dzērienu gāzu hromatogrāfija-olfaktometrija. J. Piggotā (redaktors), Alkoholiskie dzērieni: sensorā novērtēšana un patērētāju izpēte, p.101-122. Filadelfija: Woodhead Publishing.
- Kas ir migla? (2017. gada 12. jūlijs). Met Office (Apvienotā Karaliste). metoffice.gov.uk
- Helmenstine, A. M ... (2016, 16. februāris). Kāds ir etiķa ķīmiskais sastāvs? Saturs iegūts 2017. gada 17. oktobrī, no thinkco.com
- Phinney, D. J. un Halstead, J. H. (2017). Zobu palīgs: visaptveroša pieeja. Massachusetts: Cengage Learning.
- Britannica, E. (s.f.). Šķīdums-ķīmija Izgūti no britannica.com
- Vikipēdija. (s.f.). Šķīdība. Izgūti no en.wikipedia.org
- Classzone (s.f.). Risinājumi. Izgūti no frsd.k12.nj.us
- ChemGuide. (s.f.). Piesātinātie šķīdumi un šķīdība. Izgūti no chem.libretexts.org
- Madhusha (s.f.). Starpība starp šķīdinātāju un šķīdinātāju. Izgūti no pediaa.com.


