Propilēna ķīmiskā struktūra, īpašības un pielietojumi
The propilēns vai propēns istabas temperatūrā un atmosfēras spiedienā ir gāzveida stāvoklī un, tāpat kā citi alkēni, ir bezkrāsains. Tam ir smarža, kas ir līdzīga eļļai, bet ir mazāk intensīva. Tam ir dipola moments, jo, lai gan tai nav spēcīgas polārās saites, tā molekula ir asimetriska.
Arī propilēns ir ciklopropāna strukturāls izomērs (tiem ir tāda pati ķīmiskā formula C)3H6). Tas notiek dabā kā veģetācijas un fermentācijas procesu sekas. Mākslīgi rodas fosilā kurināmā, piemēram, naftas, dabasgāzes un mazākā mērā oglekļa, pārstrādes laikā.

Tāpat etilēns un propilēns ir naftas pārstrādes produkti, sadalot lielas ogļūdeņražu molekulas, lai radītu mazus ogļūdeņražus ar augstu pieprasījumu..
Propilēnu var iegūt arī, izmantojot dažādas metodes:
- Atgriezeniski reaģējot ar etilēnu un butēnu, kur divkāršās saites tiek sadalītas un pārformulētas, lai iegūtu propilēnu.
- Ar propāna dehidrogenēšanas procesu (ūdeņraža zudumu).
- Kā daļu no programmas olefīnu ražošanai no metanola (MTO) propilēnu ražoja no metanola. Tas tika izvadīts caur ceolīta katalizatoru, kas veicina tā dehidratāciju un izraisa etilēna un propilēna veidošanos..
3CH3OH (metanols) => CH3CH = CH2 (propilēns) + 3H2O (ūdens)
Indekss
- 1 Ķīmiskā struktūra
- 2 Rekvizīti
- 2.1. Molekulmasa
- 2.2 Viršanas punkts
- 2.3 Kušanas punkts
- 2.4 Uzliesmošanas temperatūra
- 2.5. Šķīdība
- 2.6 Šķīdība, izteikta kā masa
- 2.7 Blīvums
- 2.8. Tvaika blīvums
- 2.9 Tvaika spiediens
- 2.10
- 2.11 Viskozitāte
- 2.12 Degšanas siltums
- 2.13 Iztvaicēšanas siltums
- 2.14 Virsmas spriedze
- 2.15 Polimerizācija
- 2.16. Sasalšanas punkts
- 2.17 Smaržas slieksnis
- 3 Lietojumi
- 3.1 Polipropilēns
- 3.2. Akrilnitrils
- 3.3. Propilēna oksīds
- 3.4 Alkoholu un citu lietojumu sintēzei
- 4 Atsauces
Ķīmiskā struktūra
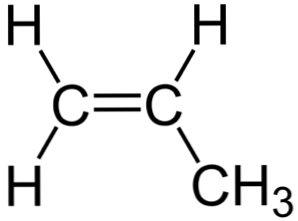
Iepriekš redzamajā attēlā var redzēt propilēna ķīmisko struktūru, kurā izceļas tās asimetrija (labā puse atšķiras no kreisās puses). Tās oglekļa skelets, neietverot H atomus, var tikt novērots kā bumerangs.
Šis bumerangs rada nepiesātināšanos vai divkāršu saiti vienā no tās malām (C1), un tāpēc tas ir plakans spibridizācijas dēļ2 oglekļa atomiem.
Tomēr otru pusi aizņem metilgrupa (-CH3), kuru hibridizācija ir sp3 un tai ir tetraedriska ģeometrija. Līdz ar to, skatoties no priekšpuses, bumerangs ir plakans, un H atomiem tas ir izvirzīts aptuveni 109,5º.
Gāzes fāzē molekula mijiedarbojas ar citiem ar dispersijas spēkiem. Arī metilgrupa novērš mijiedarbību starp divu propilēna molekulu divkāršajām saitēm (π-π).
Tas samazina to starpmolekulāros spēkus, kas atspoguļojas to fizikālajās īpašībās. Tikai ļoti zemā temperatūrā propilēns var izturēt cietu struktūru, kurā boomerāns saglabājas grupēti ar vāju mijiedarbību.
Rekvizīti
Tā ir bezkrāsaina gāze ar aromātisku smaržu. To transportē sašķidrinātas gāzes veidā un, kad tā izplūst no tvertnēm, kas to satur, tas notiek gāzes vai šķidruma veidā. Zemās koncentrācijās tas veido sprādzienbīstamu un uzliesmojošu maisījumu ar gaisu, propilēna blīvums ir augstāks nekā gaisa blīvums.
Molekulmasa
42,081 g / mol
Viršanas punkts
53,9 ° F līdz 760 mmHg
48 ° C līdz 760 mmHg
Kušanas punkts
301,4 ° F
185 ° C
Uzliesmošanas punkts
162 ° F
Šķīdība
44,6 ml / 100 ml ūdenī.
1250 ml / 100 ml etanola.
524,5 ml / 100 ml etiķskābē.
Šķīdība, izteikta kā masa
200 mg / l 25 ° C
Blīvums
0,609 mg / ml pie -52,6ºF
0,5139 pie 20ºC
Tvaika blīvums
1,46 līdz 32 ° F (attiecībā pret gaisu, kas ņemta kā atsauce).
1,49 (gaisa = 1).
1,91 kg / m3 līdz 273,15 ° K
Tvaika spiediens
1 mmHg pie -205,4ºF
760 mmHg līdz -53.9 ° F
8,69 × 103 mmHg pie 25 ° C (ekstrapolēta vērtība).
1,158 kPa pie 25 ° C
15,4 atm pie 37 ° C
Pašaizliedzība
851 ° F
455 ° C
Viskozitāte
83,4 mikropārsas pie 16,7 ° C.
Degšanas siltums
16 692 BTU / lb
10,940 cal / g
Iztvaikošanas siltums
104,62 cal / g (viršanas temperatūrā)
Virsmas spriedze
16,7 din / cm pie 90 ° C
Polimerizācija
Polimerizējas augstā temperatūrā un augstā spiedienā katalizatoru klātbūtnē.
Sasalšanas punkts
185,25 ° C.
Smaržas slieksnis
10-50 mg / m3 (noteikšana)
100 mg / m3 (atzīšana)
Lietojumi

To izmanto naftas ķīmijas rūpniecībā kā degvielu un alkilējošu aģentu. Ķīmijas rūpniecībā to izmanto kā izejvielu daudzu atvasinājumu ražošanai un sintēzei.
Tas galvenokārt izmanto polipropilēna, akrilnitrila (ACN), propilēna oksīda (PO), spirtu, kumēna un akrilskābes ražošanā..
Polipropilēns
Polipropilēns ir viens no galvenajiem plastmasas materiāliem, ko izmanto elektronikā un elektriskajos piederumos, sadzīves priekšmetos, pudeļu vāciņos un čemodānos.
Laminēto materiālu izmanto saldumu, etiķešu, kompaktdisku uc iepakojumā, bet šķiedras izgatavo no mapēm un drēbēm..
Akrilnitrils
Elastomēru polimēri un šķiedras iegūst no akrilnitrila. Šīs šķiedras ir paredzētas dažādu apģērbu, piemēram, džemperu, zeķu un sporta apģērbu, ražošanai. Tos izmanto arī mājas mēbelēs, mapēs, polsterējumos, spilvenos un segās.
Propilēna oksīds
Propilēna oksīds piedalās kā poliuretāna sintēzes sastāvdaļa. To izmanto elastīgu putu un cietu putu ražošanā. Elastīgas putas tiek izmantotas kā mājas mēbeļu un automobiļu rūpniecības pildviela.
No otras puses, cietas putas galvenokārt izmanto kā ēku izolācijas materiālu.
Turklāt propilēna oksīds tiek izmantots propilēnglikola ražošanā. Šo savienojumu izmanto nepiesātināto poliestera sveķu ražošanā un kā antifrīzs.
Turklāt propilēna oksīds tiek izmantots propilēnglikola ētera ražošanā. Šis ēteris ir piemērots krāsu, apģērbu, tintes, sveķu un tīrīšanas līdzekļu ražošanai.
Alkoholu un citu lietojumu sintēzei
Propilēns ļauj iegūt dažus spirtus, tostarp izopropanolu, ko izmanto kā šķīdinātāju kosmētikas un personīgās higiēnas līdzekļos. Turklāt tas pilda antiseptiska līdzekļa funkciju.
- Izopropanols ir iesaistīts krāsu, sveķu, tintes un līmlentes ražošanā. To izmanto arī farmācijas nozarē.
- Oksoalkohol2-etilheksanolu izmanto ftalātu, plastifikatoru, līmes materiālu un krāsu ražošanā..
- Butanolu izmanto krāsu, pārklājumu, sveķu, krāsvielu, farmaceitisko vielu un polimēru ražošanā.
No otras puses, kumēns tiek iegūts no propilēna un benzola kombinācijas. Kumēns ir galvenais savienojums fenola un acetona ražošanā, ko izmanto dažādos produktos, piemēram, polikarbonātos, fenola sveķos, epoksīdsveķos un metilmetakrilātā..
Visbeidzot, akrilskābi - citu produktu, kas iegūts no propilēna - izmanto, lai ražotu akrila esterus un sveķus krāsām, pārklāšanai un līmēšanai..
Atsauces
- Michal Osmenda (2007. gada 26. decembris). Apgaismojiet manu uguni. [Attēls] Saturs iegūts 2018. gada 23. maijā no: commons.wikimedia.org
- Linde grupa. (2018). Propilēns Saturs iegūts 2018. gada 23. maijā no: linde-gas.com
- Vikipēdija. (2018). Propēns Saturs iegūts 2018. gada 23. maijā no: en.wikipedia.org
- PubChem. (2018). Propilēns Saturs iegūts 2018. gada 27. maijā no: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (2011. gada 7. februāris). Propilēns Saturs iegūts 2018. gada 27. maijā no: thermopedia.com
- Jeffrey S. Plotkin. (2016. gada 8. augusts). Propilēna kvandārs. Saturs iegūts 2018. gada 27. maijā, no: acs.org
- ICIS. (2017. gada 6. novembris). Propilēna izmantošana un tirgus dati. Saturs iegūts 2018. gada 27. maijā no: icis.com


