Kalcija hidroksīds Formula, īpašības, reaktivitāte un pielietojumi
The kalcija hidroksīds, ir pazīstams arī kā hidratēts kaļķis vai kaļķa kaļķis, ir neorganisks savienojums ar formulu Ca (OH).2.
Kalcija hidroksīdam piemīt polimēra struktūra, tāpat kā visi metālu hidroksīdi, kas ir identiski magnija hidroksīda (Mg (OH)) struktūrai.2) pazīstams arī kā brucita.
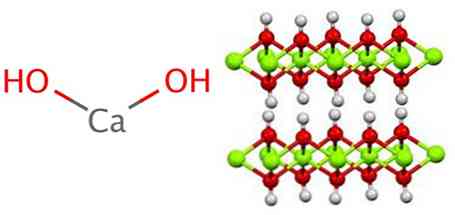
Ir redzams, ka šajā struktūrā veidojas ūdeņraža tilti. Kalcija hidroksīds tiek sintezēts rūpnieciski, kalcija oksīdu, kas pazīstams arī kā kaļķis vai kārta, reaģējot ar ūdeni, reaģējot uz šādu reakciju:
CaOH + H2O → Ca (OH)2
To sagatavo arī laboratorijā, reaģējot uz ūdens kalcija hlorīdu un nātrija hidroksīdu.
Kalcija hidroksīds rodas dabiskā veidā, bet retos gadījumos - minerālūdenī kā portlandīts, kas atrodams dažos vulkāna un metamorfos iežos. (Kalcija hidroksīda formula - kalcija hidroksīda izmantošana, īpašības, struktūra un formula, 2005-2017).
Šis savienojums ir pieejams arī cementa, šķīdinātāja un rūpnieciskās tīrīšanas līdzekļos (piemēram, būvizstrādājumos), grīdas noņēmēji, ķieģeļu tīrīšanas līdzekļi, cementa biezināšanas produkti un daudzi citi..
Ūdens šķīdums parasti tiek saukts par limewater. Kaļķu ūdeni sagatavo, sajaucot kalcija hidroksīdu tīrā ūdenī un filtrējot Ca (OH) lieko daudzumu.2 nav izšķīdis.
Ja kaļķa ūdenim pievieno lieko kalcija hidroksīdu, tiek iegūts kalcija hidroksīda daļiņu suspensija, kas dod piena izskatu, un tādā gadījumā tam ir parastais kaļķa piena nosaukums. Kaļķu pienam vai piesātinātajam kaļķa šķīdumam (kaļķa ūdenim) pH ir 12,3, kam ir pamata raksturs.
Kalcija hidroksīda fizikālās un ķīmiskās īpašības
Kalcija hidroksīds ir balts vai bezkrāsains pulveris, kam nav smakas. Ūdens šķīdumā (piesātinātie šķīdumi) tā ir piena izskats neizšķīdušā kalcija hidroksīda virspusē.
Nepiesātinātie šķīdumi parasti ir caurspīdīgi un bezkrāsaini šķīdumi ar nelielu zemu smaržu un rūgtu sārmainu kalcija hidroksīda garšu. Savienojuma izskats ir parādīts 3. attēlā (Royal Society of Chemistry, 2015).

Kalcija hidroksīda molekulmasa ir 74,093 g / mol un blīvums cietā stāvoklī ir 2,211 g / cm3. Tā kušanas temperatūra ir 580 grādi pēc Celsija. Tas slikti šķīst ūdenī, spēj izšķīdināt 1,89 gramus litrā pie 0 ° C, 1,73 gramus litrā pie 20 ° C un 0,66 gramus litrā pie 100 ° C..
Tas šķīst glicerīnā un skābes šķīdumos. Tā nešķīst spirtā (Nacionālais biotehnoloģijas informācijas centrs, S.F.).
Kalcija hidroksīds ir daļēji izšķīdināts ūdenī, lai iegūtu šķīdumu, ko sauc par limewater, kas ir mērena bāze. Kaļķa ūdens vai Ca (OH)2 (aq) Tas reaģē ar skābēm, lai veidotu sāļus un var uzbrukt dažiem metāliem, piemēram, alumīnijam. Kaļķa ūdens viegli reaģē ar oglekļa dioksīdu, veidojot kalcija karbonātu, kas ir noderīgs process, ko sauc par karbonāciju:
Ca (OH)2 + CO2 → CaCO3 + H2O
Nitroparafīni, nitrometāns, nitropropāns uc veido sāļus ar neorganiskām bāzēm, piemēram, kalcija hidroksīdu. Šie sausie sāļi ir sprādzienbīstami. Savienojums ir ķīmiski līdzīgs nātrija hidroksīdam (NaOH) vai nātrija oksīdam (Na2O). Tās neitralizē skābes eksotermiski, veidojot sāļus un ūdeni.
Šo materiālu sajaukšana ar ūdeni var radīt nedrošus siltuma daudzumus, jo pamatne izšķīst vai atšķaida. Bāzes reaģē ar dažiem metāliem (piemēram, alumīniju un cinku), veidojot metāla oksīdus vai hidroksīdus un radot ūdeņraža gāzi.
Bāzes var ierosināt polimerizācijas reakcijas polimerizējamos organiskos savienojumos, īpaši epoksīdos. Ar amonija sāļiem, nitrīdiem, halogenētiem organiskiem savienojumiem, dažādiem metāliem, peroksīdiem un hidroperoksīdiem var radīt uzliesmojošas un / vai toksiskas gāzes. Šāda veida savienojums bieži kalpo kā katalizators (ķīmiskā datu lapa CALCIUM HYDROXIDE, S.F.).
Reaktivitāte un apdraudējumi

Kalcija hidroksīds ir stabils savienojums, lai gan tas nav savienojams ar spēcīgām skābēm. Tas ir klasificēts kā kairinošs savienojums, un no tā briesmām mēs varam izcelt:
Tā ir kodīga acīm (tās izraisa radzenes bojājumus vai aklumu) un ādu (tās rada iekaisumu un blisterus)..
Putekļu ieelpošana radīs kuņģa-zarnu trakta vai elpceļu kairinājumu, ko raksturo dedzināšana, šķaudīšana un klepus. Smaga pārmērīga ekspozīcija var izraisīt plaušu bojājumus, asfiksiju, bezsamaņu vai nāvi. Acu iekaisumu raksturo apsārtums, kairinājums un nieze (Materiālu drošības datu lapa Kalcija hidroksīds, 2013).
Atkārtota acu pakļaušana zemam putekļu daudzumam var izraisīt kairinājumu un vietēju ādas bojājumu vai dermatītu uz ādas. Atkārtota putekļu ieelpošana var radīt dažāda līmeņa elpceļu kairinājumu vai plaušu bojājumus.
Ja šī viela nonāk saskarē ar acīm, tās nekavējoties jānomazgā ar lielu ūdens daudzumu, reizēm pacelot apakšējo un augšējo plakstiņu. Jānodrošina tūlītēja medicīniskā palīdzība. Kontaktlēcas nedrīkst izmantot, strādājot ar šo ķīmisko vielu.
Ja šī ķīmiska viela nonāk saskarē ar ādu, nekavējoties jāskalo ar ziepēm un ūdeni piesārņotā āda. Ja šī ķīmiskā viela iekļūst apģērbā, nekavējoties izņemiet apģērbu un izskalojiet ādu ar ūdeni. Ja pēc mazgāšanas turpinās kairinājums, meklējiet medicīnisko palīdzību.
Ja šīs vielas daudzums ir ieelpots, pakļautā persona nekavējoties jāpārvieto uz svaigu gaisu. Ja elpošana ir apstājusies, atdzīviniet muti no mutes, kā arī saglabājot upuri siltu un atpūtu. Pēc iespējas ātrāk saņemt medicīnisko palīdzību.
Ja norīts, nekavējoties meklēt medicīnisku palīdzību un, ja iespējams, uzrādīt iepakojumu vai etiķeti (saindēšanās ar kalcija hidroksīdu, 2017).
Pārkraušana un uzglabāšana
- Savienojums jāglabā sausā traukā.
- Neēdiet vai neieelpojiet putekļus.
- Uz šo produktu nedrīkst pievienot ūdeni.
- Ventilācijas trūkuma gadījumā nogādājiet atbilstošu elpošanas aprīkojumu.
- Izvairīties no saskares ar ādu un acīm.
- Sargāt no nesaderīgām kā skābēm.
- Uzglabāt cieši noslēgtu.
- Uzglabāt trauku vēsā un labi vēdināmā vietā. Uzglabāt temperatūrā līdz 25 grādiem pēc Celsija.
Lietojumi un lietojumprogrammas

Kalcija hidroksīds tiek ražots lielā mērogā, tas ir viegli apstrādājams, un tas parasti ir lēts, tāpēc ir daudz ievērojamu lietojumu un pielietojumu..
Nozīmīga kalcija hidroksīda lietošana ir kā flokulants ūdens un notekūdeņu attīrīšanā. Tas veido pūkainu uzlādētu cietvielu, kas palīdz noņemt mazākas daļiņas no ūdens, kā rezultātā rodas vieglāks produkts.
Šo pielietojumu nodrošina kalcija hidroksīda zemās izmaksas un zemā toksicitāte. To izmanto arī svaigā ūdens apstrādei, lai paaugstinātu ūdens pH. Mērķis ir, lai caurules nerūsētu, ja bāzes ūdens ir skābs.
Vēl viens lielisks pielietojums ir papīra rūpniecībā, kur to izmanto nātrija hidroksīda ražošanā. Šī konversija ir zināmā kraftprocesa sastāvdaļa, ko izmanto celulozes ekstrakcijā.
Dzīvības uzturēšanas sistēmās, piemēram, oglekļa dioksīda skruberī, īpaši slēgtās ķēdes niršanas respiratoros, kur litija hidroksīds, kas ir vairāk kodīgs, tiek uzskatīts par pārāk riskantu.
To lieto kā balināšanas un apmetuma sastāvdaļu ar tā sauktajām kaļķu javām. Ceļu būvniecībā kalcija hidroksīds kalpo augsnes kvalitātes uzlabošanai.
Saskaņā ar Nacionālajiem veselības institūtiem kalcija hidroksīdu parasti izmanto zobārstniecībā kā antimikrobiālu līdzekli, un tā ir izvēles viela, kas veido apikālu barjeru..
Apical šķēršļus parasti izmanto kā līdzekli, lai izvairītos no pulpālas nekrozes situācijās, kad endodontijas ķirurģija būtu īpaši sarežģīta, kas parasti ir nenobriedušu pastāvīga zoba rezultāts..
Tā kā kalcija hidroksīds var palīdzēt dezinficēt zobu, ja infekcija jau pastāv, to var izmantot kā īstermiņa ārstēšanu, lai samazinātu sāpes un iekaisumu, gatavojoties endodontijas ķirurģijai (Gottfried Schmalz, 2009).
Tas kalpo kā jūras ūdens piedeva, jo samazina atmosfēras CO2 daudzumu un mazina siltumnīcas efektu.
Metālu ražošanā kaļķi tiek ievadīti izplūdes gāzu plūsmā, lai neitralizētu skābes, piemēram, fluorīdus un hlorīdus, pirms tie nonāk atmosfērā..
Dažos matu relaksācijas produktos kā aktīvo sārmu sastāvdaļu izmanto kalcija hidroksīdu.
Saskaņā ar Kornela Materiālu izpētes centru kalcija hidroksīds var iztaisnot cirtainus matus, jo tas izjauc disulfīda saites, kas savieno cisteīnus, aminoskābes, kas ir augstākā koncentrācijā dabiski cirtainos matos. Šo saikņu izjaukšana un aizzīmogošana ar kalcija hidroksīdu pastāvīgi maina apstrādāto matu fizisko struktūru.
Bordo maisījumā kalcija hidroksīds kalpo, lai neitralizētu šķīdumu un veidotu ilgstošu fungicīdu.
To izmanto naftas pārstrādes rūpniecībā naftas piedevu (salicilātu, sulfītu, fenolu) ražošanai naftas ķīmijas rūpniecībā dažādu marku cietās eļļas ražošanai, kā arī ķīmijas rūpniecībā kalcija stearāta ražošanai. . To parasti izmanto oglekļa dioksīda un gāzes absorbcijas pārbaudei.
Kalcija hidroksīdu izmanto bremžu kluču ražošanā, sausu maisījumu pagatavošanā krāsošanai un dekorēšanai, kā arī pesticīdu maisījumu ražošanai..
To izmanto arī kā kalcija piedevu un pH / karbonāta buferi koraļļu akvakultūrai rifu akvārijos.
Tas ir "alternatīvs" dabiskais insekticīds, lielākā daļa no rāpojošiem kukaiņiem, kas mirst, saskaroties ar to, ieskaitot ērces, blusas, vaboles un kāpurus (Russiver, 2015).
Kalcija hidroksīds ir efektīvs risinājums matu atdalīšanai no dzīvnieku ādas, gatavojoties ādas ražošanai.
Kalcija hidroksīda un silta ūdens maisījums rada vannu, kurā svaigas ādas jātīra līdz četrām dienām un bieži sakrata. Šis process atbrīvo matus un ādu tādā mērā, ka to parasti var noņemt ar rokām.
Sakarā ar zemo toksicitāti un tās pamatīpašību mīkstumu, sašķeltas kaļķi pārtikas rūpniecībā plaši izmanto, lai:
- Lai precizētu cukurniedru vai cukurbiešu jēlcukuru cukura rūpniecībā, pārstrādes ūdeni alkoholiskajiem dzērieniem un bezalkoholiskajiem dzērieniem, marinētiem gurķiem un citiem pārtikas produktiem.
- Padarīt kukurūzas tortiljas (palīdziet graudu miltiem sanākt kopā). Kukurūza, kas pagatavota ar kaļķi, tiek pārveidota par nixtamālu, kas ievērojami palielina niacīna biopieejamību, to arī uzskata par garšīgāku un vieglāk sagremot..
- Tīriet sāls šķīdumu kalcija un magnija karbonātiem, lai ražotu sāli pārtikas un farmācijas vajadzībām.
- Nostipriniet augļu dzērienus, piemēram, apelsīnu sulu un mākslīgo maisījumu zīdaiņiem (BAUM, 2013).
Atsauces
- BAUM, J. (2013, 16. augusts). Kalcija hidroksīda izmantošana. Izgūti no livestrong.com: livestrong.com.
- Kalcija hidroksīds Formula - kalcija hidroksīda lietojumi, īpašības, struktūra un formula. (2005-2017). Izgūti no softschools.com.
- Kalcija hidroksīda saindēšanās. (2017. gada 7. februāris). Izgūti no medlineplus.gov.
- Ķīmiskā datu lapa CALCIUM HYDROXIDE. (S.F.). Izgūti no cameochemicals.noaa.gov.
- Gottfried Schmalz, D. A. (2009). Zobārstniecības materiālu bioloģiskā saderība. Berlīne: springers.
- Materiāla drošības datu lapa Kalcija hidroksīds. (2013. gada 21. maijs). Izgūti no sciencelab: sciencelab.com.
- Nacionālais biotehnoloģijas informācijas centrs. (S.F.). PubChem Compound datu bāze; CID = 6093208. Izgūti no pubchem.ncbi.nlm.nih.gov.
- Karaliskā ķīmijas biedrība. (2015). Kalcija hidroksīds. Izgūti no ChemSpider: chemspider.com.
- Russiver, M. (2015, 17. augusts). Kāpēc lieto kalcija hidroksīdu? Izgūti no quora: quora.com.


