Magnija hidrīda formula, ķīmiskā struktūra un īpašības
The magnija hidrīds (MgH2 molekulārā formula), ir ķīmiskais savienojums ar ūdeņraža masas saturu 7,66% un dabā sastopams kā balts kristālisks ciets. To galvenokārt izmanto citu ķīmisko vielu pagatavošanai, lai gan tas ir pētīts arī kā potenciāls ūdeņraža uzglabāšanas līdzeklis.
Tas pieder pie sālsūdens (vai jonu) hidrīdu grupas, kas definēts ar negatīvi uzlādētu H-jonu. Šie hidrīdi tiek uzskatīti par tādiem, kas veidojas no sārmu metāliem un sārmzemju metāliem, bet magnija (un berilija) gadījumā tiem ir kovalentās saites, papildus tiem joniem, kas raksturo šo hidrīdu saimi..
Indekss
- 1 Sagatavošana un formula
- 2 Ķīmiskā struktūra
- 3 Fizikālās un ķīmiskās īpašības
- 3.1 Fiziskā
- 3.2 Ķimikālijas
- 4 Lietojumi
- 4.1 Ūdeņraža uzglabāšana
- 4.2 Hidrogenēšanas un dehidrogenēšanas reakcijas
- 4.3 Dūņas
- 4.4. Kurināmā elementi
- 4.5 Transports un enerģija
- 4.6. Alkilēšana
- 5 Riski
- 5.1 Reakcija ar ūdeni
- 5.2 Tā ir piroforiska
- 6 Atsauces
Sagatavošana un formula
Magnija hidrīdu veido magnētiskā (Mg) metāla tieša hidrogenēšana augstā spiediena un temperatūras apstākļos (200 atmosfēras, 500 ° C) ar MgI katalizatoru.2. Tās reakcija ir līdzvērtīga:
Mg + H2→ MgH2
Tika pētīta arī MgH ražošana2 zemākās temperatūrās, izmantojot nanokristālisku magniju, kas ražots lodīšu dzirnavās.
Ir arī citas sagatavošanas metodes, bet tās ir sarežģītākas ķīmiskās reakcijas (magnija-antracēna hidrogenēšana, reakcija starp dietilmagnija un litija-alumīnija hidrīda un kā MgH kompleksa produkts).2).
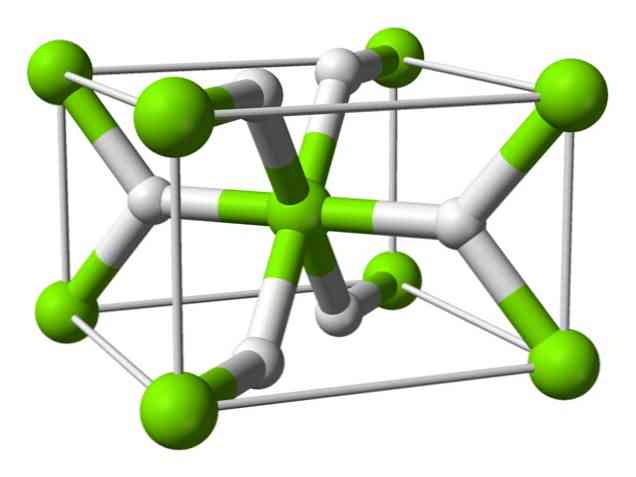
Ķīmiskā struktūra
Šis atoms satur rutila struktūru istabas temperatūrā ar tetragonālu kristālu struktūru. Augsta spiediena apstākļos tai ir vismaz četras dažādas formas, kā arī novērota nestehiometriska struktūra ar ūdeņraža trūkumiem; tā veidojas tikai nelielos daļiņu daudzumos.
Kā minēts iepriekš, saistībām, kas pastāv rutila struktūrā, ir daļēji kovalentās īpašības, nevis tās ir tīri joniskas, tāpat kā citi sālsūdens hidrīdi..
Tas izraisa magnija atoma sfērisku formu, pilnīgi jonizētu, bet tā hidrīda jonam ir iegarena struktūra.
Fizikālās un ķīmiskās īpašības
Fizisks
- Izskats: balti kristāli.
- Molārā masa: 26,3209 g / mol
- Blīvums: 1,45 g / cm3
- Kušanas punkts: 285 ° C sadalās
- Šķīdība: ūdenī sadalās.
Šim ķīmiskajam savienojumam ir molekulas masa 26,321 g / mol, blīvums 1,45 g / cm3 un tā kušanas temperatūra ir 327 ° C..
Ķimikālijas
- Prekursors citu ķīmisko vielu ražošanai.
- Ūdeņraža uzglabāšana kā iespējamais enerģijas avots.
- Samazinātājs organiskajā sintēzē.
Ir svarīgi norādīt, ka šo savienojumu nevar laist šķidrā stāvoklī, un kad tas tiek pārvadāts vai kausēts vai ievadīts ūdenī, tas sadalās. Šis hidrīds nešķīst ēterī.
Tā ir ļoti reaktīva un viegli uzliesmojoša viela, un tā ir arī piroforiska, tas nozīmē, ka tā spontāni var aizdegties gaisā. Šie trīs nosacījumi ir drošības riski, kas tiks minēti šā panta pēdējā sadaļā.
Lietojumi
Ūdeņraža uzglabāšana
Magnija hidrīds viegli reaģē ar ūdeni, veidojot ūdeņraža gāzi, izmantojot šādu ķīmisko reakciju:
MgH2+2H2O → 2H2+Mg (OH)2
Turklāt šī viela sadalās 287 ° C temperatūrā un 1 bar spiedienā šādi:
MgH2→ Mg + H2
Tādēļ ir ierosināts izmantot magnija hidrīdu kā ūdeņraža uzglabāšanas līdzekli tās izmantošanai un transportēšanai.
Metāliskā magnija daudzuma hidrogenēšana un dehidrogenēšana tiek piedāvāta kā veids, kā transportēt gāzveida ūdeņraža daudzumu, tādējādi nodrošinot, ka tās transportēšanā nav noplūdes un tas ir drošāks un praktiskāks nekā augstspiediena tvertņu izmantošana..
Hidrogenēšanas un dehidrogenēšanas reakcijas
Lai gan magnija hidrīda sadalīšanās temperatūra ir ierobežojošs faktors tās izmantošanai, ir ierosinātas metodes hidrogenēšanas un dehidrogenēšanas reakciju kinētikas uzlabošanai. Viens no tiem ir magnija daļiņu izmēra samazināšana ar lodveida dzirnavām.
Dūņas
Turklāt ir piedāvāta sistēma, kas ražo magnija hidrīdu dubļu formā (vieglāk vadāms un drošāks par pulvera vai citu cieto daļiņu), kas reaģētu ar ūdeni, lai iegūtu vēlamo ūdeņradi..
Tiek lēsts, ka iepriekš minētais dūņas veidojas ar smalki samaltu hidrīdu, kas ir aizsargāts ar aizsargājošu eļļas slāni, un suspendēts disperģējošos līdzekļos, lai nodrošinātu, ka tas saglabā konsekvenci bez materiāla zuduma, un ka tas neuzsūc mitrumu no vides..
Šī dūņa priekšrocība ir tā, ka to var sūknēt ar jebkuru parasto dīzeļdegvielas, benzīna vai ūdens sūkni, padarot šo ekonomisko piedāvājumu un efektīvu..
Degvielas elementi
Magnija hidrīdu var ieviest modernu kurināmā elementu ražošanā, kā arī bateriju un enerģijas uzglabāšanas veidošanā.
Transports un enerģija
Pēdējo desmitgažu laikā ir apsvērta ūdeņraža izmantošana kā enerģijas avots. Lai ūdeņradi implantētu kā degvielu, ir jāatrod drošas un atgriezeniskas uzglabāšanas sistēmas un augstas tilpuma ietilpības (ūdeņraža daudzums uz tilpuma vienību) un gravimetriskais (ūdeņraža daudzums uz masas vienību)..
Alkilēšana
Alkilēšana (pievieno CH alkilgrupas3R) organisko savienojumu bāzes barotnē, kur ir -OH grupas zemās koncentrācijās un temperatūrās, kas ir augstākas par hidrīda kušanas punktu..
Šajā gadījumā ūdeņradi, kas atrodas magnija hidrīdā (MgH2), pievienojiet -OH grupas, veidojot ūdeni. Brīvais magnija var saņemt halogēnu, kas bieži ir pievienots alkilmolekulai, kura paredzēta saistīties ar ogļūdeņražu ķēdi.
Riski
Reakcija ar ūdeni
Kā jau minēts, magnija hidrīds ir viela, kas ļoti viegli un stipri reaģē ar ūdeni, radot spēju eksplodēt augstākās koncentrācijās.
Tas notiek tāpēc, ka tā eksotermiskā reakcija rada pietiekami daudz siltuma, lai aizdegtu sadalīšanās reakcijā izdalīto ūdeņraža gāzi, radot diezgan bīstamu ķēdes reakciju..
Tā ir piroforiska
Magnija hidrīds ir arī piroforisks, kas nozīmē, ka tas spontāni var aizdegties mitra gaisa klātbūtnē un veido magnija oksīdu un ūdeni..
Tās ieelpošana nav ieteicama cietā stāvoklī vai saskarē ar tvaikiem: viela dabiskā stāvoklī un tās sadalīšanās produkti var izraisīt nopietnus ievainojumus vai pat nāvi..
Tas var radīt kodīgus šķīdumus saskarē ar ūdeni un piesārņot to. Saskare ar ādu un acīm nav ieteicama, kā arī rada kairinājumu gļotādām.
Nav pierādīts, ka magnija hidrīds var radīt hronisku ietekmi uz veselību, piemēram, vēzi, reproduktīvo defektu vai citas fiziskas vai garīgas sekas, bet, lietojot to, ieteicams izmantot aizsargaprīkojumu (jo īpaši respiratorus vai maskas, to iedarbībai). smalks putekļu raksturs).
Strādājot ar šo vielu, gaisa mitrums ir jāsaglabā zemā līmenī, jāizdzēš visi aizdegšanās avoti un jāpārvadā to tvertnēs vai citos konteineru konteineros..
Jums vienmēr jāizvairās no lielas šīs vielas koncentrācijas, ja to var novērst, jo sprādziena iespēja ievērojami samazinās.
Ja parādās magnija hidrīda noplūde, darba zona ir jāizolē un putekļi jāsavāc ar putekļsūcēju. Nekad neizmantojiet sausās slaucīšanas metodi; palielina reakcijas ar hidrīdu izredzes.
Atsauces
- Zumdahl, S. S. (1998). Encyclopedia Britannica. Ņemts no britannica.com.
- PubChem. (2005). PubChem Open ķīmijas datu bāze. Ņemts no pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Zaļo automašīnu kongress. Ņemts no greencarcongress.com.
- Ķimikālijas, C. (n.d.). Cameo Chemicals. Ņemts no cameochemicals.noaa.gov.
- Services, N. J. (1987). Ņūdžersijas Veselības un vecāko pakalpojumu departaments. Ņemts no nj.gov.


