Molekulārā ģeometrijas veidi un piemēri
The molekulārā ģeometrija o molekulārā struktūra ir atomu telpiskais sadalījums ap centrālo atomu. Atomi pārstāv reģionus, kuros ir augsts elektroniskais blīvums, un tādēļ tie tiek uzskatīti par elektroniskām grupām, neatkarīgi no saitēm, kas veidojas (viena, divkārša vai trīskārša).
Šī koncepcija rodas no divu teoriju kombinācijas un eksperimentāliem datiem: valences saite (TEV) un valences korpusa (VSPR) elektronisko pāru atgrūšanās. Pirmais definē saites un to leņķus, bet otrā nosaka ģeometriju un līdz ar to molekulāro struktūru.

Kādas ģeometriskās formas ir molekulas, kas spēj pieņemt? Abas iepriekšējās teorijas sniedz atbildes. Saskaņā ar VSEPR brīvo elektronu atomiem un pāriem jābūt novietotiem telpā tādā veidā, lai samazinātu elektrostatisko atgrūšanu starp tiem..
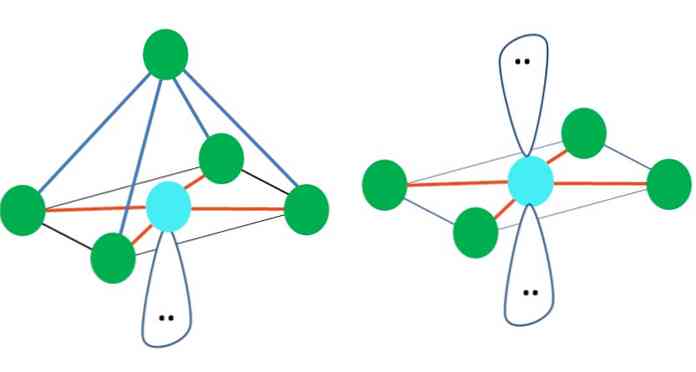
Tātad ģeometriskās formas nav patvaļīgas, bet meklē visstabilāko dizainu. Piemēram, augšējā attēlā kreisajā pusē var redzēt trijstūri un pa labi - oktaedru. Zaļie punkti attēlo atomus un oranžās svītras saites.
Trīsstūrī trīs zaļie punkti ir orientēti 120 ° atdalīšanā. Šis leņķis, kas ir vienāds ar saiknes leņķi, ļauj atomiem cīnīties viens otru pēc iespējas mazāk. Tāpēc molekula ar centrālo atomu, kas pievienots trim citiem, pieņems trigonālās plaknes ģeometriju.
Tomēr VSCR prognozē, ka brīvais elektronu pāris centrālajā atomā izkropļos ģeometriju. Attiecībā uz trigonālo plakni šis pāris nospiež trīs zaļos punktus, kā rezultātā radīsies trigonāla piramīda ģeometrija.
Tas pats var notikt arī ar attēla oktaedru. Tajā visi atomi ir atdalīti pēc iespējas stabilākā veidā.
Indekss
- 1 Kā iepriekš uzzināt atoma X molekulāro ģeometriju?
- 2 veidi
- 2.1. Linear
- 2.2. Leņķis
- 2.3. Tetrahēlija
- 2.4 Trigonālais bipiramīds
- 2,5 oktaedrāls
- 2.6. Citas molekulārās ģeometrijas
- 3 Piemēri
- 3.1. Lineārā ģeometrija
- 3.2. Stūra ģeometrija
- 3.3. Trigonālais plāns
- 3.4. Tetrahēlija
- 3.5 Trigonālā piramīda
- 3.6 trigonālais bipiramīds
- 3.7
- 3.8. T forma
- 3.9. Octahedral
- 4 Atsauces
Kā jau iepriekš zināt atom X molekulāro ģeometriju?
Šim nolūkam ir jāapsver arī brīvo elektronu pāri kā elektroniskās grupas. Tie kopā ar atomiem noteiks to, kas ir pazīstams kā elektroniskā ģeometrija, kas ir neatņemama molekulārās ģeometrijas biedrs.
No elektroniskās ģeometrijas un pēc Lewis struktūras atklāšanas brīvo elektronu pāri, mēs varam noteikt, kāda būs molekulārā ģeometrija. Visu molekulāro ģeometriju summa sniegs globālās struktūras izklāstu.
Veidi
Kā redzams galvenajā attēlā, molekulārā ģeometrija ir atkarīga no tā, cik daudz atomu ieskauj centrālo atomu. Tomēr, ja elektronu pāris atrodas bez koplietošanas, tas mainīs ģeometriju, jo tas aizņem lielu apjomu. Tāpēc tas rada sterilu efektu.
Saskaņā ar to ģeometrija var radīt virkni raksturīgu formu daudzām molekulām. Un šeit rodas dažāda veida molekulārā ģeometrija vai molekulārā struktūra.
Kad ģeometrija ir vienāda ar struktūru? Abi apzīmē tikai tos gadījumus, kad konstrukcijai nav vairāk nekā viena ģeometrijas veida; pretējā gadījumā ir jāņem vērā visi pašreizējie veidi un struktūra jādod globālajam nosaukumam (lineāra, sazarota, globāla, plakana utt.).
Ģeometrijas ir īpaši noderīgas, lai izskaidrotu cietās struktūras struktūru no tās struktūrvienībām.
Lineāri
Visas kovalentās saites ir virzītas, tāpēc saite A-B ir lineāra. Bet vai AB molekula būs lineāra?2? Ja jā, ģeometrija ir vienkārši attēlota kā: B-A-B. Abi B atomi ir atdalīti ar leņķi 180 °, un saskaņā ar TEV, A jābūt sp hibrīdiem orbitāliem.
Leņķis
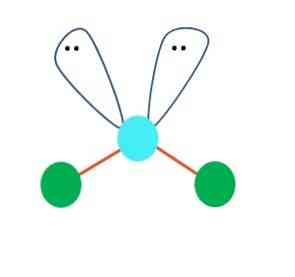
Pirmajā instancē var pieņemt, ka AB molekulai ir lineāra ģeometrija2; tomēr ir būtiski izdarīt Lewis struktūru pirms secinājuma izdarīšanas. Zīmējot Lewis struktūru, var identificēt elektronu pāru skaitu bez dalīšanas (:) uz A atoma.
Kad tas tā ir, elektronu pāru virspusē tie nospiež abus B atomus, mainot to leņķus. Rezultātā lineārā molekula B-A-B kļūst par V, bumerangu vai leņķa ģeometriju (augšējais attēls)
Ūdens molekula H-O-H ir ideāls piemērs šāda veida ģeometrijai. Skābekļa atomā ir divi elektronu pāri bez dalīšanas, kas ir orientēti aptuveni 109 ° leņķī.
Kāpēc šis leņķis? Tā kā elektroniskā ģeometrija ir tetraedriska, kurai ir četras virsotnes: divas H atomiem un divas - elektroniem. Augstāk redzamajā attēlā atzīmējiet, ka zaļie punkti un abas "cilpas ar acīm" zīmē tetretedru ar zilganu punktu tās centrā.
Ja O nebūtu brīvu elektronu pāru, ūdens veidotu lineāru molekulu, tā polaritāte samazināsies un okeāni, jūras, ezeri utt., Visticamāk, nepastāvētu, jo tie ir zināmi..
Tetrahedral
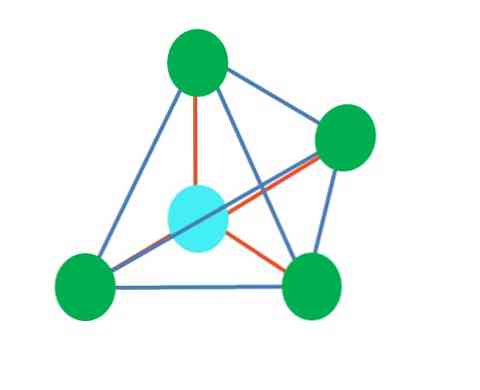
Augšējais attēls ir tetraedriskā ģeometrija. Ūdens molekulai tās elektroniskā ģeometrija ir tetraedriska, bet, likvidējot elektronu nesaturošos pārus, var pamanīt, ka tas tiek pārveidots par leņķveida ģeometriju. Tas ir arī novērots, vienkārši likvidējot divus zaļos punktus; atlikušie divi zīmēs V ar zilo punktu.
Ko darīt, ja divu brīvo elektronu pāri būtu tikai viens? Tad būs trigona plakne (galvenais attēls). Tomēr, novēršot elektronisku grupu, netiek novērsta brīvo elektronu pāru radītā steriskā iedarbība. Tāpēc tas izkropļo trigonālo plakni uz trīsstūra pamata piramīdu:

Lai gan trigonālā un tetraedriskā piramīda molekulārā ģeometrija ir atšķirīga, elektroniskā ģeometrija ir tāda pati: tetraedriskā. Tātad trigonālā piramīda netiek uzskatīta par elektronisku ģeometriju?
Atbilde ir nē, jo tas ir rezultāts no izkropļojumiem, ko izraisa "daivas ar acīm" un tās steriskā iedarbība, un šī ģeometrija neņem vērā vēlākos izkropļojumus.
Šī iemesla dēļ vienmēr ir svarīgi vispirms noteikt elektronisko ģeometriju ar Lewis struktūru palīdzību pirms molekulārās ģeometrijas noteikšanas. Amonjaka molekula, NH3, ir trigonālās piramīdas molekulārās ģeometrijas piemērs, bet ar tetraedru elektronisko ģeometriju.
Trigonālais bipiramīds
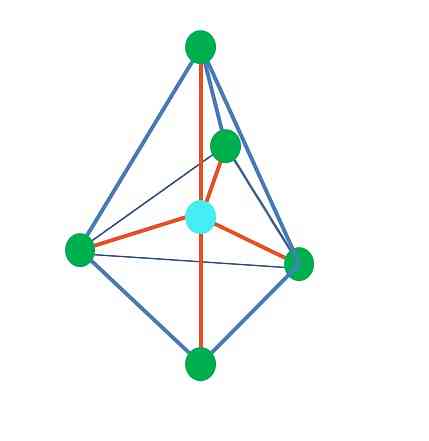
Līdz šim, izņemot lineāro ģeometriju, leņķiskā un trigonālā piramīda tās centrālajos atomos ir hibridizācija.3, saskaņā ar TEV. Tas nozīmē, ka, ja jūsu saiknes leņķi tika noteikti eksperimentāli, tiem jābūt aptuveni 109º.
No trigonālās dipiramīda ģeometrijas ir piecas elektroniskās grupas ap centrālo atomu. Augšējā attēlā var redzēt piecus zaļos punktus; trīs trīsstūrveida pamatnē un divi aksiālās pozīcijās, kas ir piramīdas augšējā un apakšējā virsotne.
Kāda hibridizācija ir zilajam punktam? Lai izveidotu vienkāršas saites (oranžā krāsā), ir nepieciešamas piecas hibrīda orbītas. Tas tiek panākts ar piecām sp orbitālēm3d (orbītas s, trīs p un a d maisījuma produkts).
Apsverot piecas elektroniskās grupas, ģeometrija ir tā, kas jau ir pakļauta, bet elektronu pāriem nav kopīgas, un tas atkal cieš no traucējumiem, kas rada citas ģeometrijas. Rodas arī šāds jautājums: vai šie pāri var ieņemt jebkuru vietu piramīdā? Tie ir: aksiālais vai ekvatoriālais.
Aksiālie un ekvatoriālie stāvokļi
Zaļie punkti, kas veido trīsstūrveida pamatu, ir ekvatoriālās pozīcijās, bet divi augšējā un apakšējā galā - aksiālās pozīcijās. Ja vēlams, vai elektronu pāris nebūs izvietots? Šajā pozīcijā, kas samazina elektrostatisko atgrūšanu un sterisko efektu.
Aksiālā stāvoklī elektronu pāris "triecieniem" uz trijstūra pamatnes "perpendikulāri" (90º), bet, ja tas būtu ekvatoriālajā pozīcijā, divas atlikušās bāzes pamatgrupas būtu 120º attālumā un nospiediet abus galus 90º (nevis trīs, tāpat kā bāze).
Tāpēc centrālais atoms mēģinās orientēt elektronu brīvos pārus ekvatoriālajās pozīcijās, lai radītu stabilākas molekulārās ģeometrijas.
Oscilējoša un T forma
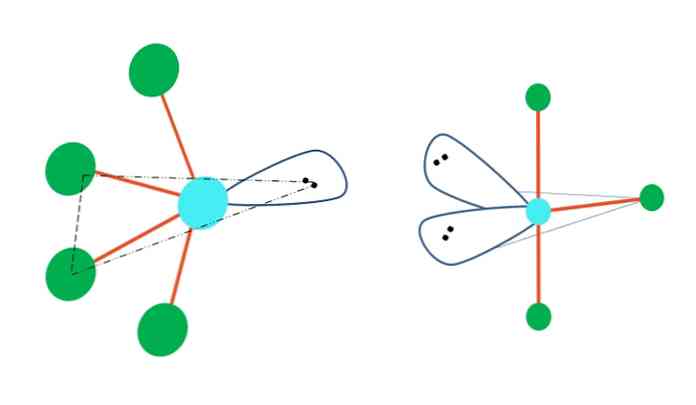
Ja trigonālā bipiramīda ģeometrija aizstātu vienu vai vairākus tās atomus ar elektroniem brīviem pāriem, tai būtu arī dažādas molekulārās ģeometrijas.
Pa kreisi no augšējā attēla ģeometrija mainās uz svārstīgo formu. Tajā brīvais elektronu pāris nospiež pārējos četrus atomus vienā virzienā, salokot to saites pa kreisi. Ņemiet vērā, ka šis pāris un divi atomi atrodas vienā un tajā pašā trijstūra plaknē.
Un pa labi no attēla - T veida ģeometrija - šī molekulārā ģeometrija ir divu atomu aizvietošanas rezultāts diviem elektronu pāriem, kā rezultātā atlikušie trīs atomi ir izlīdzināti tajā pašā plaknē, kas vērš tieši vienu burtu T.
Tātad, AB tipa molekulai5, tā pieņem trigonālo bipiramīdu ģeometriju. Tomēr, AB4, ar tādu pašu elektronisko ģeometriju, tā pieņems svārstīgo ģeometriju; un AB3, T-veida ģeometrijā visiem tiem ir (parasti) spibridizācija3d.
Lai noteiktu molekulāro ģeometriju, ir nepieciešams izdarīt Lewis struktūru un līdz ar to tās elektronisko ģeometriju. Ja tas ir trigonāls bipiramīds, tad elektroni nesaturošie pāri tiks izmesti, bet ne to steriskie efekti uz pārējiem atomiem. Tādējādi ir iespējams pilnīgi atšķirt trīs iespējamās molekulārās ģeometrijas.
Octahedral
Oktaedrālā molekulārā ģeometrija ir attēlota pa labi no galvenā attēla. Šis ģeometrijas veids atbilst AB savienojumiem6. AB4 tie veido kvadrātveida pamatni, bet pārējie divi B ir novietoti asu pozīcijās. Tādējādi veidojas vairāki vienādmalu trijstūri, kas ir oktaedrera sejas.
Šeit atkal var būt (tāpat kā visās elektroniskajās ģeometrijās) brīvi elektronu pāri, un tāpēc no šī fakta izriet citas molekulārās ģeometrijas. Piemēram, AB5 ar astoņstūra elektronisko ģeometriju veido piramīda ar kvadrātveida pamatni un AB4 kvadrātveida plakne:
Oktaedrālās elektroniskās ģeometrijas gadījumā šīs divas molekulārās ģeometrijas ir visstabilākās elektrostatiskās atgrūšanas ziņā. Kvadrātveida plaknes ģeometrijā abi elektronu pāri ir 180 ° attālumā.
Kāda ir hibridizācija atomiem A šajās ģeometrijās (vai struktūrās, ja tā ir vienīgā)? Atkal, TEV konstatē, ka tā ir sp3d2, seši hibrīda orbitāli, kas ļauj A orientēt elektroniskās grupas oktaedrera virsotnēs.
Citas molekulārās ģeometrijas
Mainot līdzšinējo piramīdu bāzes, var iegūt dažas sarežģītākas molekulārās ģeometrijas. Piemēram, piecstūrveida bipiramīds balstās uz piecstūri un savienojumiem, kas to veido, ir vispārēja formula AB7.
Tāpat kā citas molekulārās ģeometrijas, B atomu aizstāšana ar elektroniem brīviem pāriem izkropļos ģeometriju uz citām formām.
Arī AB savienojumi8 viņi var pieņemt tādas ģeometrijas kā kvadrātveida prizma. Dažas ģeometrijas var būt ļoti sarežģītas, īpaši AB formulām7 (līdz AB12).
Piemēri
Tālāk tiks minētas virknes savienojumu par katru no galvenajām molekulārajām ģeometrijām. Kā vingrinājums, jūs varētu izdarīt Lewis struktūras visām piemēriem un apliecināt, vai, ņemot vērā elektronisko ģeometriju, jūs iegūsiet molekulārās ģeometrijas, kas uzskaitītas zemāk..
Lineārā ģeometrija
-Etilēns, H2C≡CH2
-Berilija hlorīds, BeCl2 (Cl-Be-Cl)
-Oglekļa dioksīds, CO2 (O = C = O)
-Slāpeklis, N2 (N≡N)
-Dzīvsudraba dibromīds, HgBr2 (Br-Hg-Br)
-Anjonu trijodīds, I3- (I-I-I)
-Ūdeņraža cianīds, HCN (H-N≡C)
Tā leņķiem jābūt 180º, un tātad tiem ir jābūt hibridizācijai.
Leņķa ģeometrija
-Ūdens
-Sēra dioksīds, SO2
-Slāpekļa dioksīds, NO2
-Ozons, O3
-Anion amiduro, NH2-
Trigonālā plakne
-Broma trifluorīds, BF3
-Alumīnija trihlorīds, AlCl3
-Nitrātu anjons, NO3-
-Anjonu karbonāts, CO32-
Tetrahedral
-Metāna gāze, CH4
-Oglekļa tetrahlorīds, CCl4
-Katjonu amonija, NH4+
-Anjonu sulfāts, SO42-
Trigonālā piramīda
-Amonjaks, NH3
-Katjonu hidronijs, H3O+
Trigonālais bipiramīds
-Fosfora pentafluorīds, PF5
-Antimons Pentahlorīds, SbF5
Svārstīgs
Sēra tetrafluorīds, SF4
T forma
-Joda trihlorīds, ICl3
-Hlorīda trifluorīds, ClF3 (abi savienojumi ir pazīstami kā interhalogēni)
Octahedral
-Sēra heksafluorīds, SF6
-Selēna heksafluorīds, SeF6
-Heksafluorofosfāts, PF6-
Lai sasniegtu kulmināciju, molekulārā ģeometrija izskaidro vielas ķīmisko vai fizikālo īpašību novērojumus. Tomēr tas ir orientēts atbilstoši elektroniskajai ģeometrijai, lai pēdējais vienmēr būtu jānosaka pirms pirmā.
Atsauces
- Whitten, Davis, Peck & Stanley. Ķīmija (8. izdevums). CENGAGE Learning, 194-198. Lpp.
- Shiver & Atkins. (2008). Neorganiskā ķīmija (Ceturtais izdevums., 23., 24., 80., 169. lpp.). Mc Graw kalns.
- Mark E. Tuckerman. (2011). Molekulārā ģeometrija un VSEPR teorija. Saturs iegūts no: nyu.edu
- Virtual Chembook, Charles E. Ophardt. (2003). Ievads molekulārajā ģeometrijā. Saturs iegūts no: chemistry.elmhurst.edu
- Ķīmija LibreTexts. (2016. gada 8. septembris). Molekulu ģeometrija. Saturs iegūts no: chem.libretexts.org


