Alumīnija hlorīda (AlCl3) ķīmiskā struktūra, īpašības, izmantošana
The alumīnija hlorīds vai alumīnija trihlorīds (AlCl3) ir binārs sāls, ko veido alumīnijs un hlors. Dažreiz tas parādās kā dzeltens pulveris, jo tas satur piemaisījumus dzelzs (III) hlorīda klātbūtnes dēļ.
To iegūst, apvienojot tā elementus. Alumīnijs, kuram pēdējos enerģijas līmeņos ir trīs elektroni (IIIA ģimene), to metāliska rakstura dēļ rada tos. Hlora ar septiņiem elektroniem pēdējā enerģijas līmenī (VIIA ģimene) mēdz iegūt tos, lai pabeigtu oktetu.
Tiek uzskatīts, ka alumīnija un hlora savienojums alumīnija trihlorīdā ir kovalens, lai gan tas ir savienojums starp metālu un nemetālu..
Ir divu veidu alumīnija hlorīds:
- Bezūdens alumīnija hlorīds. AlCl3.
- Alumīnija hlorīda heksahidrāts. AlCl3. 6H2O. Šo savienojumu var atrast cietā vai šķīduma formā.
Indekss
- 1 Ķīmiskā struktūra
- 2 Rekvizīti
- 2.1. Fiziskā
- 2.2 Ķīmiskā viela
- 3 Lietojumi
- 4 Riski: iespējamā ietekme
- 5 ieteikumi
- 6 Atsauces
Ķīmiskā struktūra
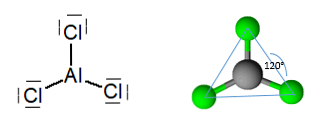
Bezūdens alumīnija trihlorīds ir molekula ar plakanu trigonālu ģeometriju, ar leņķi 120 °, kas atbilst atomu hibridizācijai.2.
Tomēr molekula ir organizēta kā dimeri, kurā hlora atoms ziedo pāri elektroniem, lai izveidotu saites. Tos sauc par koordinētām kovalentām obligācijām.
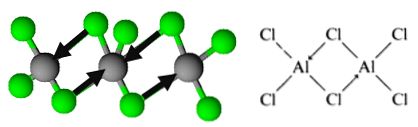
Tādā veidā tiek secināts alumīnija trihlorīda dimeru organizācija.
Šī organizācija ļauj savienojumam veidot dimerisko slāņu tīklus. Kad uz cietā alumīnija trihlorīda izlej ūdeni, tie nesadalās, kā paredzēts, no jonu savienojumiem, bet notiek spēcīga hidrolīze..
Gluži pretēji, atšķaidītā ūdens šķīdumā ir koordinēti joni [Al (H2O)6]+3 un hlorīdu. Šīs struktūras ir ļoti līdzīgas diborāna struktūrām.
Tādā veidā jums ir formula Al2Cl6
Ja mēra atšķirību starp šo savienojumu veidojošo atomu elektronegativitāti, var novērot:
Alumīnija Al elektronegativitātes vērtība ir 1,61 C un hlora vērtība ir 3,16 C. Elektronegativitātes atšķirība ir 1,55 C.
Saskaņā ar saistošas teorijas noteikumiem, lai savienojums būtu jonu savienojums, tam jābūt atšķirīgam atomu elektronegativitātei, kas veido saiti ar vērtību, kas ir lielāka vai vienāda ar 1,7 C.
Al-Cl saiknes gadījumā elektronegativitātes atšķirība ir 1,55 C, kas nodrošina alumīnija trihlorīda kovalentu savienojumu. Šo nelielo vērtību var attiecināt uz molekulā parādītajām koordinētajām kovalentajām saitēm.
Rekvizīti
Fizisks
Izskats: balta cieta viela, dažkārt dzeltena dzelzs hlorīda izraisīto piemaisījumu dēļ
Blīvums: 2,48 g / ml
Molārā masa133,34 g / mol
Sublimācija: sublimē pie 178 ° C, tāpēc tā kušanas un viršanas temperatūra ir ļoti zema.
Braukšana: slikti veic elektrību.
Šķīdība: tas nav šķīstošs ūdenī, jo tas ir Lewis skābe. Tas šķīst organiskos šķīdinātājos, tādos kā benzols, tetrahlorogleklis un hloroforms.
Ķimikālijas
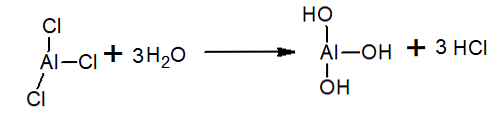
Ūdenī alumīnija trihlorīds tiek hidrolizēts, veidojot HCl un hidronija jonu un alumīnija hidroksīdu:
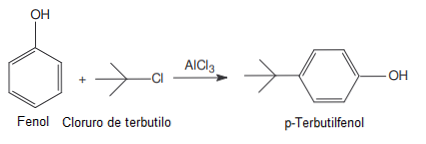
To lieto Friedel-Crafts reakcijās kā katalizatoru (viela, ko var atgūt reakcijas beigās, jo tā tikai paātrina, palēnina vai sāk reakciju)..
Tā ir kodīga viela.
Sadaloties, kad tas krasi reaģē ar ūdeni, tas ražo alumīnija oksīdu un bīstamas gāzes, piemēram, sālsūdeņradi.
Lietojumi
- Pretsviedru līdzekļi.
- Katalizators Friedel-Crafts acilēšanai un alkilēšanai.
Riski: iespējamā ietekme
- Tā ir kodīga viela, izraisa ādas apdegumus un nopietnus acu bojājumus.
- Reaģē spēcīgi ar ūdeni.
- Tas ir bīstams videi.
- Ļoti toksisks ūdens organismiem.
Ieteikumi
Izvairieties no produkta iedarbības bez nepieciešamajiem drošības pasākumiem. Jāizmanto, aizsargbrilles, cimdi, piemērots apģērbs, apvalks.
Ieelpojot. Putekļu ieelpošana var kairināt elpceļus, jo viela ir kodīga. Simptomi ir iekaisis kakls, klepus un elpas trūkums. Plaušu tūskas simptomi var būt novēloti un smagi gadījumi var būt letāli. Pārvietojiet cietušo uz gaisīgu vietu bez piesārņotājiem. nodrošināt mākslīgo elpināšanu, ja nepieciešams. Ja Jums ir apgrūtināta elpošana, nodrošina skābekli. Zvaniet ārstam.
Ja nonāk saskarē ar ādu. AlCl3 Tas ir kodīgs. Tas var izraisīt kairinājumu vai apdegumus ar apsārtumu un sāpēm. Nekavējoties nomazgāt vismaz 20 minūtes pēc saskares ar lielu daudzumu ūdens. Neitralizējiet vai nepievienojiet citas vielas, izņemot ūdeni. Noņemiet piesārņoto apģērbu un nomazgājiet to pirms atkārtotas lietošanas. nekavējoties jākonsultējas ar ārstu traumu gadījumā.
Ja nokļūst acīs. AlCl3 Tas ir kodīgs. Tas izraisa stipras sāpes, neskaidru redzējumu un audu bojājumus. Nekavējoties skalot acis ar ūdeni vismaz 20 minūtes un turiet acu plakstiņus atvērtus, lai nodrošinātu, ka visa acs un plakstiņu audi ir iztīrīti. Lai panāktu maksimālu efektivitāti, acu skalošana dažu sekunžu laikā ir būtiska. Ja Jums ir kontaktlēcas, izņemiet tās pēc pirmajām 5 minūtēm un pēc tam turpiniet skalot acis. Konsultējieties ar ārstu. Tas var izraisīt nopietnu radzenes, konjunktīvas vai citu acs daļu bojājumus.
Norīšanas gadījumā. AlCl3 Tas ir kodīgs. Degšana var izraisīt sāpes mutē un barības vadā un gļotādu apdegumus. Tas var izraisīt kuņģa-zarnu trakta diskomfortu ar sāpēm vēderā, sliktu dūšu, vemšanu un caureju. NELIETOJIET VOMITĒŠANU. Izskalot muti un dzert ūdeni. Nekad nedodiet neko mutiski bezsamaņā esošai personai. Zvaniet ārstam. Ja vemšana notiek spontāni, novietojiet cietušo uz viņa pusi, lai samazinātu aspirācijas risku.
Cilvēki ar esošiem ādas traucējumiem vai acu problēmām vai elpošanas funkcijas traucējumiem var būt jutīgāki pret vielas iedarbību
AlCl savienojuma iepakošana un uzglabāšana3 jāveic vēdināmās, tīras un sausās vietās.
Atsauces
- Ķīmiskā grāmata, (2017), alumīnija hlorīds. Atgūts no chemicalbook.com
- kosmosa online, cosmos.com.mx
- Sharpe, A.G., (1993), Organic Chemistry, Spānija, Redakcija Reverté, S.A..
- F., (2017), AlCl alumīnija hlorīds3, Zīmotnes. Noņemtsblog.elinsignia.com.
- TriHealth, (2018), alumīnija trihlorīds, pēdējais atjauninājums, 2018. gada 4. marts, izgūti no trihealth.adam.com.
- RxWiki, (s.f), alumīnija hlorīds, izgūts no rxwiki.com.


