Propānskābes formula, īpašības, riski un lietošanas veidi
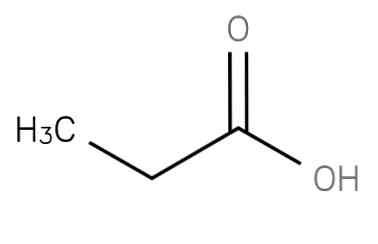
The propānskābe ir piesātināta īsa ķēdes taukskābe, kas satur etānu, kas piestiprināts pie karboksigrupas oglekļa. Tās formula ir CH3-CH2-COOH.The anjons CH3CH2COO-, kā arī propānskābes sāļi un esteri ir pazīstami kā propionāti (vai propanoāti)..
To var iegūt no koksnes atkritumiem, izmantojot fermentācijas procesu, izmantojot ģints baktērijas propionibakteriju. To iegūst arī no etanola un oglekļa monoksīda, izmantojot bora trifluorīda katalizatoru (O'Neil, 2001)..
Vēl viens veids, kā iegūt propānskābi, ir propionaldehīda oksidēšana kobalta vai mangāna jonu klātbūtnē. Šī reakcija strauji attīstās 40-50 ° C temperatūrā:
2CH3CH2CHO + O2 → 2CH3CH2COOH
Savienojums ir dabiski sastopams zemos piena produktu līmeņos, un tas tiek ražots vispārīgi kopā ar citiem īsās ķēdes taukskābēm cilvēku un citu zīdītāju kuņģa-zarnu traktā kā galīgais produkts ogļhidrātu mikrobioloģiskajā fermentācijā..
Ir ievērojama fizioloģiska aktivitāte dzīvniekiem (Human Metabolome Database, 2017).
Indekss
- 1 Fizikālās un ķīmiskās īpašības
- 2 Reaktivitāte un bīstamība
- 3 Bioķīmija
- 4 Lietojumi
- 5 Atsauces
Fizikālās un ķīmiskās īpašības
Propānskābe ir bezkrāsains un eļļains šķidrums ar smalku, nepatīkamu un rancētu smaku. Tās izskats parādīts 2. attēlā (Nacionālais biotehnoloģijas informācijas centrs, 2017).

Propānskābes molekulmasa ir 74,08 g / mol un blīvums ir 0,992 g / ml. Tās sasalšanas temperatūra un viršanas temperatūra ir attiecīgi -20,5 ° C un 141,1 ° C. Propānskābe ir vāja skābe, kuras pKa ir 4,88.
Savienojums ir ļoti labi šķīst ūdenī, spēj izšķīdināt 34,97 gramus savienojuma uz 100 ml šķīdinātāja. Tas arī šķīst etanolā, ēterī un hloroformā (Royal Society of Chemistry, 2015).
Propānskābei piemīt vidējas fizikālās īpašības, salīdzinot ar mazākām karboksilskābēm, skudrskābēm un etiķskābēm un lielākām taukskābēm..
Tas parāda karboksilskābju vispārīgās īpašības un var veidot amīda, estera, anhidrīda un hlorīda atvasinājumus. Tā var veikt alfa-halogenēšanu ar bromu PBr3 klātbūtnē kā katalizators (HVZ reakcija), veidojot CH3CHBrCOOH..
Reaktivitāte un apdraudējumi
Propānskābe ir uzliesmojošs un uzliesmojošs materiāls. To var aizdegt ar karstumu, dzirkstelēm vai liesmām. Tvaiki var veidot sprādzienbīstamus maisījumus ar gaisu, kas spēj pārvietoties uz aizdegšanās avotu un eksplodēt.
Lielākā daļa tvaiku ir smagāki par gaisu. Tie izplatīsies pa zemi un tiks savākti zemās vai slēgtās vietās (kanalizācijā, pagrabos, tvertnēs). Tvaika ieelpas draudi telpās, ārā vai kanalizācijā.
Vielas, kas apzīmētas ar (P), var eksplozīvi polimerizēties, kad tās tiek sildītas vai ietītas ugunī. Sildīšanas laikā konteineri var eksplodēt (PROPIONIC ACID, 2016).
Savienojums jāglabā prom no karstuma vai aizdegšanās avotiem. Sildot līdz sadalīšanās procesam, izdala asas dūmus un kairinošus dūmus.
Propānskābe kairina ādu, acis, degunu un rīkles, bet nerada akūtu sistēmisku iedarbību, un tai nav pierādāms genotoksicitātes potenciāls. Kontakta gadījumā mazgāt ar lielu daudzumu ūdens (Materiālu drošības datu lapa Propionskābe, 2013).
Bioķīmija
Propānskābes, propionāta, konjugāta bāze tiek veidota kā trīs oglekļa gala fragments (aktivēts ar koenzīma A kā propionil-CoA) nepāra skaitlisko oglekļa taukskābju oksidēšanā un sānu ķēdes oksidēšanā. holesterīna līmenis.
Eksperimenti ar propionāta radioaktīvajiem izotopiem, kas ievadīti tukšā dūšā, liecina, ka tas var parādīties glikogēnā, glikozes, citronskābes cikla starpproduktos, aminoskābēs un olbaltumvielās..
Propānskābes vielmaiņas ceļš ietver mijiedarbību ar koenzīma A, karboksilēšanu, veidojot metilmalonil-koenzīmu A, un pārvēršoties par glikozi, kas nonāk citronskābes ciklā..
Propānskābi var oksidēt bez ketona korpusu veidošanās, un, atšķirībā no etiķskābes, to iekļauj ogļhidrātu, kā arī lipīdu (Bingham, Cohrssen, & Powell, 2001)..
Propionskābe ir viena no visbiežāk sastopamajām organiskajām acidurijām, slimība, kas ietver daudzus dažādus traucējumus.
Pacientiem, kas dzimuši ar propionskābju skābekli, intelektuālās attīstības modeļos ir slikts rezultāts, un 60% IQ ir mazāks par 75 gadiem, kam nepieciešama īpaša izglītība..
Veiksmīga aknu un / vai nieru transplantācija dažiem pacientiem ir veicinājusi labāku dzīves kvalitāti, bet ne vienmēr ir novērsusi neiroloģiskas un viscerālas komplikācijas..
Šie rezultāti uzsver nepieciešamību pēc pastāvīgas vielmaiņas uzraudzības neatkarīgi no terapeitiskās stratēģijas.
Lietojumi
Propānskābe inhibē baktēriju un pelējuma augšanu līmenī no 0,1 līdz 1 masas%. Tā rezultātā lielākā daļa saražotā propānskābes tiek patērēta kā konservants gan barībai, gan pārtikai, piemēram, graudiem un labībai..
Barības, labības un pārtikas, kā arī kalcija un nātrija propionāta ražošana, kas veido gandrīz 80% no pasaules propānskābes patēriņa 2016. gadā, salīdzinot ar 78,5% 2012. gadā.
Aptuveni 51% pasaules propānskābes patēriņa izmanto dzīvnieku barībai un graudu saglabāšanai, bet gandrīz 29% tiek izmantoti kalcija un nātrija propionātu ražošanā, kurus izmanto arī pārtikas un barības nozarē..
Citi nozīmīgi propānskābes tirgi ir herbicīdu un dietilketona ražošana. Mazāka apjoma lietojumi ietver celulozes acetāta propionātu, farmaceitiskos preparātus, šķīdinātāju esterus, aromatizētājus un smaržvielas, plastifikatorus, krāsvielas un tekstila palīglīdzekļus, ādu un gumiju..
Pieprasījums pēc propānskābes lielā mērā ir atkarīgs no barības un labības ražošanas, kam seko iepakoti pārtikas produkti un maizes izstrādājumi..
Propānskābes un tās sāļu globālās izaugsmes iespējas dzīvnieku barībā / graudu un pārtikas saglabāšanā ir nozīmīgas (IHS Markit, 2016).
Citi strauji augoši tirgi ietver propionāta esteri šķīdinātājiem, piemēram, n-butilpropionāts un pentils; Šie esteri arvien vairāk tiek izmantoti kā šķīdinātāju aizstājēji, kas uzskaitīti kā bīstamie gaisa piesārņotāji.
Atsauces
- Bingham, E., Cohrssen, B. un Powell, C. (2001). Patty's Toxicology Volume 1-9 5. izdevums. Ņujorka: John Wiley & Sons.
- EMBL-EBI (2016. gada 14. oktobris). propionskābe. Atgūts no ChEBI: ebi.ac.uk.
- Cilvēka metabolisma datu bāze. (2017. gada 2. marts). Propionskābe. Saturs iegūts no hmdb.ca: hmdb.ca.
- IHS Markit. (2016, decembris). Ķīmiskās ekonomikas rokasgrāmata Propionskābe. Saturs iegūts no ihs: ihs.com.
- Materiāla drošības datu lapa Propionskābe. (2013. gada 21. maijs). Izgūti no sciencelab: sciencelab.com.
- Nacionālais biotehnoloģijas informācijas centrs ... (2017, 22. aprīlis). PubChem Compound datu bāze; CID = 1032. Izgūti no pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. (. (2001), The Merck Index - Ķīmisko vielu enciklopēdija, Drugs and Biologicals, 13. izdevums, Ņūdžersija: Merck un Co., Inc..
- PROPIONĀLS SKĀBUMS. (2016). Izgūti no cameochemicals: cameochemicals.noaa.gov.
- Karaliskā ķīmijas biedrība. (2015). Propionskābe. Izgūti no chemspider: chemspider.com.


