Pikricskābes struktūra, sintēze, īpašības un izmantošanas veidi
The pikricskābe ir augsti nitrēts organiskais ķīmiskais savienojums, kura nosaukums IUPAC ir 2,4,6-trinitrofenols. Tās molekulārā formula ir C6H2(NĒ2)3OH. Tas ir ļoti skābs fenols, un to var atrast kā nātriju, amonija vai kālija pikrātu; tas ir, tās jonu formā C6H2(NĒ2)3ONa.
Tā ir cieta, izturīga rūgta garša, un no tās iegūst nosaukumu no grieķu vārda “prikos”, kas nozīmē rūgtu. To konstatē kā mitrus dzeltenus kristālus. Tās žāvēšana vai dehidratācija ir bīstama, jo palielina nestabilās īpašības, kas padara to sprādzienbīstamu.
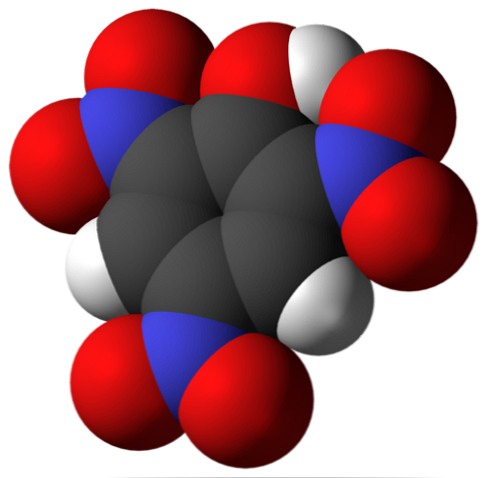
Virs ir pikricskābes molekula. Attēlā ir grūti atpazīt saites un atomus, jo tas atbilst tā Van der Waals virsmas attēlojumam. Molekulārā struktūra ir sīkāk aplūkota nākamajā sadaļā.
Daži starpprodukti, dažādi pikrāta sāļi un pikricskābes kompleksi tiek sintezēti no pikrīnskābes..
Pikricskābe tiek izmantota kā pamats dzeltenkrāsu pastāvīgo krāsvielu sintēzei. Daži patologi un pētnieki to izmanto audu sekciju fiksēšanā vai krāsošanā un citos imūnhistoķīmiskos procesos.
Tas ir ļoti noderīgs farmaceitisko produktu sagatavošanā. Turklāt to izmanto sacensību vai spēļu un sprāgstvielu ražošanā. To lieto arī metālu gravēšanai, krāsas stikla izgatavošanai un bioloģisko parametru, piemēram, kreatinīna, kolorimetriskai noteikšanai..
No otras puses, pikricskābe ir kairinoša, ja tā nonāk saskarē ar ādu, ar elpošanas, acu un gremošanas gļotādu. Papildus ādas savainošanai, tas var nopietni ietekmēt nieres, asinis un aknas citu orgānu vidū.
Indekss
- 1 Struktūra
- 1.1. Skābes fenols
- 1.2. Kristāla struktūra
- 2 Kopsavilkums
- 2.1. Fenola tiešā nitrācija
- 3 Fizikālās un ķīmiskās īpašības
- 3.1. Molekulmasa
- 3.2. Fiziskais izskats
- 3.3 Smarža
- 3.4 Garša
- 3.5. Kušanas temperatūra
- 3.6 Viršanas punkts
- 3.7 Blīvums
- 3.8 Šķīdība
- 3.9 Kodīgums
- 3.10 pKa
- 3.11 Nestabilitāte
- 4 Lietojumi
- 4.1. Pētījumi
- 4.2. Organiskā ķīmija
- 4.3
- 4.4. Militārie lietojumi
- 5 Toksicitāte
- 6 Atsauces
Struktūra

Augšējā attēlā sīkāk ir parādītas visas pikricskābes molekulas saites un struktūra. Tas sastāv no fenola ar trim nitro aizvietotājiem.
To var redzēt NO grupās2 slāpekļa atoms ir pozitīvi daļēji uzlādēts, un tāpēc pieprasījums pēc tās apkārtnes elektroniskā blīvuma. Bet aromātiskais gredzens arī piesaista elektronus sev un pirms trim NO2 tas beidzas, atmetot daļu sava elektroniskā blīvuma.
Tā rezultātā OH grupas skābeklis vairāk dalās vienā no saviem brīvajiem elektroniskajiem pāriem, lai piegādātu gredzena elektronisko trūkumu; un to darot, izveidojas C = O saite+-H. Šī daļējā daļējā slodze uz skābekli vājina O-H saiti un palielina skābumu; tas ir, tas tiks izlaists kā ūdeņraža jonu, H+.
Skābes fenols
Šī iemesla dēļ šis savienojums ir ārkārtīgi spēcīgs (un reaktīvs) skābe, pat vairāk nekā paša etiķskābe. Tomēr savienojums patiešām ir fenols, kura skābums pārsniedz citu fenolu līmeni; kā minēts iepriekš, NO aizvietotājiem2.
Tāpēc, tā kā tā ir fenols, OH grupai ir prioritāte un novirza struktūru. Trīs NO2 tie atrodas aromātiskā gredzena 2, 4 un 6 oglekļa atomu daļā attiecībā pret OH. Tādējādi IUPAC nomenklatūra šim savienojumam: 2,4,6-trinitrofenols (TNP, tā akronīms angļu valodā).
Ja grupas nav2, vai arī, ja gredzenā bija mazāks skaits, O-H saite mazināsies, un tādēļ savienojumam būtu zemāks skābums.
Kristāla struktūra
Pikricskābes molekulas ir sakārtotas tā, lai veicinātu to savstarpējo mijiedarbību; vai nu ūdeņraža tiltu veidošanai starp OH un NO grupām2, dipola-dipola spēki vai elektrostatiskie atgrūšanas traucējumi starp nepietiekamiem elektronu reģioniem.
Varētu sagaidīt, ka grupas NĒ2 tie atbaidīja viens otru un būtu vērsti uz kaimiņu aromātiskajiem gredzeniem. Arī gredzenus nevarēja izlīdzināt viens ar otru, palielinot elektrostatisko atgrūšanu.
Visu šo mijiedarbību produkts, pikricskābe spēj veidot trīsdimensiju tīklu, kas definē kristālu; kuru vienības šūna atbilst ortorombiskā tipa kristāliskai sistēmai.
Sintēze
Sākotnēji tas tika sintezēts no dabiskiem savienojumiem, piemēram, dzīvnieku ragu atvasinājumiem, dabīgiem sveķiem. Kopš 1841. gada fenols ir izmantots kā pikricskābes prekursors, sekojot vairākiem ceļiem vai izmantojot dažādas ķīmiskās procedūras.
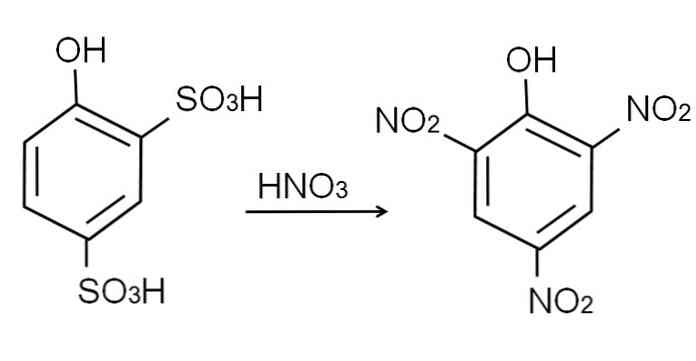
Kā jau minēts, tas ir viens no skābākajiem fenoliem. Lai to sintezētu, vispirms ir nepieciešams, lai fenols tiktu pakļauts sulfonēšanas procesam, kam seko nitrēšanas procedūra.
Bezūdens fenola sulfonēšana tiek veikta, apstrādājot fenolu ar dūmojošu sērskābi, ar aromātiskiem H aizvietojumiem ar sulfonātu grupām, SO3H, -ort pozīcijā un -OH grupā.
Šim produktam, 2,4-fenoldisulfīnskābe, tiek veikta nitrēšanas process, apstrādājot to ar koncentrētu slāpekļskābi. To darot, divas SO grupas3H aizvieto ar nitro grupām, NO2, un trešā iekļūst citā nitro stāvoklī. To parāda šāds ķīmiskais vienādojums:
Fenola tiešā nitrēšana
Fenola nitrēšanas procesu nevar veikt tieši, jo rodas liela molekulmasa darvas. Šī sintēzes metode prasa ļoti rūpīgu temperatūras kontroli, jo tā ir ļoti eksotermiska:
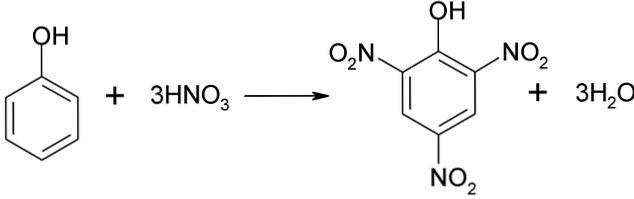
Pikricskābi var iegūt, veicot tiešu nitrēšanas procesu 2,4-dinitrofenolam ar slāpekļskābi.
Vēl viens sintēzes veids ir benzola apstrāde ar slāpekļskābi un dzīvsudraba nitrātu.
Fizikālās un ķīmiskās īpašības
Molekulmasa
229,104 g / mol.
Fiziskais izskats
Mitru kristālu masa vai dzeltena suspensija.
Smarža
Tas ir bez smaržas.
Garša
Tas ir ļoti rūgts.
Kušanas punkts
122,5 ° C.
Viršanas punkts
300 ° C Bet, kad tas kūst, tas eksplodē.
Blīvums
1,77 g / ml.
Šķīdība
Tas ir vidēji ūdenī šķīstošs savienojums. Tas ir tāpēc, ka viņu OH un NO grupas2 tie var mijiedarboties ar ūdens molekulām, izmantojot ūdeņraža saites; lai gan aromātiskais gredzens ir hidrofobs, un tāpēc tā šķīdība ir traucēta.
Kodīgums
Pikrīnskābe kopumā ir kodīga metāliem, izņemot alvu un alumīniju.
pKa
0,38. Tā ir spēcīga organiskā skābe.
Nestabilitāte
Pikricskābei raksturīgas nestabilas īpašības. Tas rada risku videi, tas ir nestabils, sprādzienbīstams un toksisks.
Lai izvairītos no dehidratācijas, tas ir jāuzglabā cieši noslēgtā veidā, jo pikīna skābe ir ļoti sprādzienbīstama. Ir jābūt ļoti uzmanīgiem ar bezūdens formu, jo tas ir ļoti jutīgs pret berzi, triecienu un siltumu.
Pikricskābe jāuzglabā vēsā, vēsā vietā, prom no oksidējamiem materiāliem. Tas kairina ādu un gļotādas, to nedrīkst norīt un toksisks organismam.
Lietojumi
Pikricskābe ir plaši izmantota pētniecībā, ķīmijā, rūpniecībā un militārajā jomā.
Izmeklēšana
Ja to lieto kā šūnu un audu fiksatoru, tā uzlabo to krāsu rezultātus ar skābām krāsvielām. Tas notiek ar trihromu krāsošanas metodēm. Pēc audu nostiprināšanas ar formalīnu ieteicama jauna fiksācija ar pikricskābi.
Šādā veidā tiek garantēta intensīva un ļoti spilgta audu krāsa. Labi rezultāti nav iegūti ar pamata krāsvielām. Tomēr jāveic piesardzības pasākumi, jo pikricskābe var hidrolizēt DNS, ja paliek pārāk daudz laika.
Organiskā ķīmija
-Organiskajā ķīmijā to izmanto kā sārmainu pikrātu, lai veiktu dažādu vielu identifikāciju un analīzi.
-To izmanto metālu analītiskajā ķīmijā.
-Klīniskajās laboratorijās to izmanto, lai noteiktu seruma un urīna kreatinīna līmeni.
-To izmanto arī dažos reaģentos, ko izmanto glikozes līmeņa analīzei.
Nozarē
-Fotogrāfijas industrijas līmenī fotoelektriskās emulsijās kā sensibilizators tika izmantota pikricskābe. Tā ir bijusi daļa no tādu produktu kā pesticīdu, spēcīgu insekticīdu izstrādes.
-Picric skābi izmanto, lai sintezētu citus starpposma ķīmiskos savienojumus, piemēram, hloropiksīnu un pikramskābi. No šiem savienojumiem ir izstrādātas dažas ādas izstrādājumu zāles un krāsvielas.
-Picric skābi lietoja, lai ārstētu apdegumus, kā antiseptiskus un citus apstākļus, pirms tā toksiskums tika pierādīts..
-Svarīga sastāvdaļa, pateicoties sprādzienbīstamībai spēļu un bateriju ražošanā.
Militārie lietojumi
-Tā kā pikricskābe ir ļoti sprādzienbīstama, to izmanto militāro ieroču munīcijas ražotnēs.
-Presētā un izkausētā pikricskābe ir izmantota artilērijas čaulās, granātās, bumbās un raktuvēs.
-Pikējošās skābes amonija sāls ir izmantots kā sprāgstviela, tas ir ļoti spēcīgs, bet mazāk stabils nekā TNT. Jau kādu laiku to izmantoja kā raķešu degvielas sastāvdaļu.
Toksicitāte
Ir pierādīts, ka tas ir ļoti toksisks cilvēka ķermenim un kopumā visām dzīvajām būtnēm.
Tā akūtās orālās toksicitātes dēļ ieteicams izvairīties no tās ieelpošanas un norīšanas. Tas izraisa arī mutāciju mikroorganismos. Nodrošina toksisku iedarbību uz savvaļas dzīvniekiem, zīdītājiem un kopumā vidē.
Atsauces
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organiskā ķīmija. Amīni (10. \ Tth izdevumā.). Wiley Plus.
- Carey F. (2008). Organiskā ķīmija (Sestais izdevums). Mc Graw kalns.
- Vikipēdija. (2018). Pikricskābe. Saturs iegūts no: en.wikipedia.org
- Purdue universitāte. (2004). Piktrīnskābes sprādziens. Saturs iegūts no: chemed.chem.purdue.edu
- Crystallography 365 projekts. (2014. gada 10. februāris). Mazāk nekā maigs dzeltens - pikricskābes struktūra. Saturs iegūts no: crystallography365.wordpress.com
- PubChem. (2019). Pikricskābe Saturs iegūts no: pubchem.ncbi.nlm.nih.gov
- Bakers, J. R. (1958). Pikricskābe Methuen, London, UK.


