Hlorhlorskābes (HClO) formula, īpašības un lietošanas veidi
The hipohlorīdskābe, pazīstams arī kā monoksoklorskābe (I), ir ķīmiskais savienojums ar formulu HClO. Tā ir vienkārša molekula ar centrālo skābekli, kas savienots ar hlora un ūdeņraža atomiem, izmantojot vienkāršas saites.
Tas ir hlora oksīds, kam ir valence (I). Tā ir vāja skābe, kas parasti veidojas, kad hlors izšķīst ūdenī. Ir atsauce uz vairākiem citiem nosaukumiem, piemēram: hlorskābe, hloranols, ūdeņraža hipohlorīts un hlora hidroksīds.
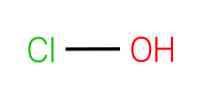
Hipohlorīdskābi cilvēka organismā rada balto asins šūnu, lai cīnītos pret infekcijām, jo tā iedarbojas uz dažādiem mikroorganismiem..
Hlora pievienošana ūdenim dod hipohlora skābi kopā ar sālsskābi (HCl):
Cl2 + H2O OC HOCl + HCl
Iepriekš minētā reakcija ir līdzsvarā, un nav viegli izdalīt HOCl no šī maisījuma. Tomēr stabilus hipohloru sāļus var iegūt, izšķīdinot hlora gāzi nātrija hidroksīda šķīdumā vai citos ūdens bāzes šķīdumos.
HOCl var arī pagatavot, izšķīdinot dichlorīna monoksīdu ūdenī (hlorhlorīda skābes, īpašības, struktūra un formula, S.F.)..
Cl2O + H2O → 2HOCl
Indekss
- 1 Fizikālās un ķīmiskās īpašības
- 2 Pretmikrobu iedarbība
- 3 Lietojumi
- 3.1 Hlorohidrīna veidošanās
- 3.2. Kosmētikas rūpniecība
- 3.3 Ūdens attīrīšana
- 3.4 Nieze
- 4 Atsauces
Fizikālās un ķīmiskās īpašības
Hipohlorīdskābe pastāv tikai kā ūdens šķīdums. Tas ir bezkrāsains šķīdums, un tā precīzās fizikālās īpašības ir mainīgas, jo tās ir atkarīgas no šķīduma koncentrācijas. Bezūdens vai sausā hipohlorīda skābe nav iespējama, jo molekula ir līdzsvarā ar tās anhidrīdu (Nacionālais biotehnoloģijas informācijas centrs, 2017)..
Tā molekulmasa ir 52,46 g / mol, un tā pKa ir 7,53. Tas šķīst ūdenī.
HOCl ir spēcīgs oksidētājs un var veidot sprādzienbīstamus maisījumus. Tas ir arī reducējošs līdzeklis, kas spēj oksidēties uz skābes hlora, hlora un perhlora formām. Ūdens šķīdumos, kas ir vāja skābe, tā daļēji disociējas hipohlorīta jonā (OCl-) un H+.
HOCl reaģē ar bāzēm, veidojot sāļus, ko sauc par hipohlorītiem. Piemēram, nātrija hipohlorīts (NaOCl), aktīvā sastāvdaļa balinātājā, veidojas, reaģējot ar hlorhlorīdu ar nātrija hidroksīdu (Royal Society of Chemistry, 2015).
HOCl + NaOH → NaOCl + H2O
Hipohlorīdskābe arī viegli reaģē ar dažādām organiskām molekulām un biomolekulām.
Hidrohlorīdskābe netiek uzskatīta par kaitīgu, jo tā cilvēka organismā notiek zemā koncentrācijā un tam piemīt pretmikrobu iedarbība.
Hipohlorīdskābe lēni reaģē ar DNS un RNS, kā arī visiem nukleotīdiem in vitro.
GMP ir visreaktīvākā, jo HClO reaģē gan ar heterociklisko NH grupu, gan ar aminogrupu.
Tāpat TMP ar tikai vienu heterociklisku NH grupu, kas reaģē ar HClO, ir otrā reaktīvākā.
AMP un CMP, kam ir tikai viena lēna reaktīva aminogrupa, ir mazāk reaktīvas ar HClO.
Ir ziņots, ka UMP ir reaktīvs tikai ļoti lēni. Heterocikliskās NH grupas ir reaktīvākas nekā amino grupas, un to sekundārie hloramīni var ziedot hloru..
Šīs reakcijas, iespējams, traucē DNS bāzes savienošanu, un saskaņā ar to ir ziņots par HClO iedarbībai pakļautās DNS viskozitātes samazināšanos, kas ir līdzīga tai, kas novērota ar siltuma denaturāciju (Prütz, 1996)..
Cukura paliekas nav reaktīvas un DNS mugurkauls nesalauž. NADH var reaģēt ar hlorētu TMP un UMP, kā arī HClO. Šī reakcija var atjaunot UMP un TMP, kā rezultātā rodas NADH 5-hidroksi atvasinājums.
Reakcija ar TMP vai UMP ir lēna atgriezeniska, lai reģenerētu HClO. Otra, lēnāka reakcija, kas izraisa piridīna gredzena sadalīšanos, rodas, ja klāt ir HClO. NAD + ir inerts pret HClO.
Pretmikrobu iedarbība
Pēdējo 15 gadu laikā vismodernākās hipohlorīdskābes šķīdumi, kas balstīti uz elektrochēmiju, ir kļuvuši par drošiem un dzīvotspējīgiem brūču tīrīšanas līdzekļiem, kā arī papildu terapijām infekciju ārstēšanai..
Hipohlorīdais šķīdums (HOCl) ir spēcīgs oksidētājs un mēdz novērst elektronus no citas vielas. Tās nātrija sāls, nātrija hidroksīds (NaClO) vai tā kalcija sāls, kalcija hidroksīds (Ca (ClO) 2) parasti tiek izmantoti balinātājos, dezodorantos un dezinfekcijas līdzekļos..
HOCl ir dabisks endogēns komponents cilvēkiem un dzīvniekiem, un tā ir nozīmīga iedzimta imūnsistēmas sastāvdaļa. HOCl veido neitrofilu granulocīti, kas ir vislielākais balto asinsķermenīšu veids zīdītājiem. Ir iesaistīts Oksidatīvā ceļa pēdējā posmā cīņā pret infekcijām un svešu vielu invāziju.
Ja šūna atklāj svešas vielas iebrukumu, tā izpaužas fagocitozē, kuras laikā neitrofīliņi iekļūst un internalizē mikroorganismus vai svešas daļiņas. Šis fagocītiskais notikums izraisa reaktīvo skābekļa sugu un hidrolītisko enzīmu sekrēciju (Kavros, S.F.)..
Skābekļa patēriņš reaktīvo skābekļa sugu radīšanā, ko sauc par "reaktīvo sprādzienu", ietver NADPH oksidāzes, kas ražo lielu daudzumu superoksīda, aktivāciju..
Šī ļoti reaktīvā skābekļa viela sadalās ūdeņraža peroksīdā, ko pēc tam pārvērš HOCl. HOCl iedarbojas uz baktericīdām īpašībām un nekavējoties iznīcina neitrofilu norīšanas baktērijas. Neskatoties uz HOCl būtisko aktivitāti pret mikroorganismiem, tas nav citotoksisks cilvēka vai dzīvnieku šūnām. Tas, iespējams, ir saistīts ar tā endogēno klātbūtni zīdītāju šūnu imūnā sistēmā (Chanson Water Ionizers USA, Inc, 2016).

Nesen ir ierosināts, ka baktēriju inaktivācija ar HOCl ir DNS replikācijas inhibīcijas rezultāts. Ja baktērijas tiek pakļautas HOCl iedarbībai, strauji samazinās DNS sintēze, kas ir pirms proteīna sintēzes inhibīcijas, un ir ļoti līdzīga dzīvotspējas zudumam (Davies, 1988)..
Baktēriju genoma replikācijas laikā replikācijas izcelsme (oriC E. coli) saistās ar proteīniem, kas ir saistīti ar šūnu membrānu, un tika novērots, ka ārstēšana ar HOCl samazina oriC izdalīto membrānu afinitāti, un šī afinitāte samazinās paralēli dzīvotspējas zaudēšanai.
Henrija Rozena darbā (1998) viņi salīdzināja HOCl inhibīcijas ātrumu plazmīdas DNS replikācijai ar dažādām replikācijas izcelsmes vietām un konstatēja, ka, salīdzinot ar plazmīdiem, kas bija plazmas, kavējas replikācijas inhibēšana. tie satur oriC. Rozena grupa ierosināja, ka DNS replikācijā iesaistīto membrānu proteīnu inaktivācija ir HOCl darbības mehānisms.
Lietojumi
Hlorhidrīnu veidošanās
Hlorhlorīdskābe tiek izmantota organiskā sintēze, alkēnus pārveidojot par hlorhidrīniem.
Hipohlorīdskābe reaģē ar nepiesātinātajām saitēm lipīdos, bet ne piesātinātajās saitēs, un ClO-jonu nepiedalās šajā reakcijā.
Šo reakciju iegūst hidrolīzes ceļā, pievienojot hloru vienam no oglekliem un vienu hidroksilu otram. Iegūtais savienojums ir hlorhidrīns. Polārais hlors izjauc lipīdu divslāņus un var palielināt caurlaidību.
Kad hlorohidrīna veidošanās notiek sarkano asins šūnu lipīdu divslāņos, palielinās caurlaidība. Pārtraukums var rasties, ja veidojas pietiekami daudz hlorhidrīna.
Preformētu hlorhidrīnu pievienošana sarkanajām asins šūnām var ietekmēt arī caurlaidību. Ir novēroti arī holesterīna hlorhidrīni, taču tie būtiski neietekmē caurlaidību, un tiek uzskatīts, ka par šo reakciju atbild Cl2.
Kosmētikas rūpniecība
Kosmētikas nozarē to izmanto kā ādas tīrīšanas līdzekli, kas dod labumu ķermeņa ādai, nevis žāvēšanai. To lieto arī zīdaiņu produktiem, jo bērna āda ir īpaši jutīga, un to var viegli kairināt.
Ūdens attīrīšana
Ūdens attīrīšanā hipohlorīdskābe ir aktīvs dezinfekcijas līdzeklis ar hipohlorīta produktiem (piemēram, to izmanto peldbaseinos)..
Pārtikas pakalpojumu un ūdens sadales jomā dažkārt tiek izmantotas speciālas iekārtas, kas rada vāju HClO šķīdumu no ūdens un sāls, lai iegūtu pietiekamu daudzumu droša (nestabila) dezinfekcijas līdzekļa, lai ārstētu pārtikas sagatavošanas virsmas un izejvielas. ūdens.
Pruritus ārstēšana
Nesen ir ierosināta lokāla hipohlora skābe (HOCl) kā nieze. Ir ierosināti divi mehānismi, ar kuriem HOCl var samazināt niezi:
1) HOCl ir īpaši mikrobicīds pret ādas patogēniem Staphylococcus aureus atopiskā dermatīta gadījumā.
2) HOCl ir pretiekaisuma līdzeklis un samazina histamīna, leikotriēna B4 un interleikīna-2 darbību, kas visi ir iesaistīti niezes patofizioloģijā..
Ir apstākļi, kādos HOCl var izraisīt niezi kā nelabvēlīgu ietekmi. Piemēram, HOCl palielina nervu augšanas faktora aktivitāti, kas veicina niezi. Ilgstoša iedarbība vai augsta HOCl deva var izraisīt arī kairinošu kontakta dermatītu vai retāk alerģisku kontaktdermatītu (Robert Y. Pelgrift, 2013).
Atsauces
- Chanson Water Ionizers USA, Inc. (2016). hipohlora skābes atklāšana. Atgūts no chansonalkalinewater: chansonalkalinewater.com.
- Davies, S. M. (1988). Baktēriju augšanas kavēšana ar hipohlora skābi. Iespējamā loma fagocītu baktericīdajā aktivitātē. Biochem J. 254 (3), 685-692. ncbi.nlm.nih.gov.
- EMBL-EBI (2014. gada 31. marts). hipohlorīdskābe. Izgūti no ebi.ac.uk: ebi.ac.uk.
- Henry Rosen, B. R. (1998). Myeloperoksidāzes atvasināto oksidantu diferenciālā iedarbība uz Escherichia coli DNS replikāciju. Infekcijas imunitāte. 66 (6), 2655-2659. ncbi.nlm.nih.gov.
- Hlorhlorskābes izmantošana, īpašības, struktūra un formula. (S.F.). Atgūtās desoftschools: softschools.com.
- Kavros, S. (S.F.). Hidrohlorīda skābes šķīduma izmantošana brūču ārstēšanā. Atgūts no faim.org.
- Nacionālais biotehnoloģijas informācijas centrs ... (2017. gada 25. marts). PubChem Compound datu bāze; CID = 24341. Izgūti no PubChem.
- Prütz, W. A. (1996). Hipohlorskābes mijiedarbība ar tioliem, nukleotīdiem, DNS un citiem bioloģiskiem substrātiem. Biochemistry and Biophysics arhīvs 332. sējums, 1. izdevums, 110-120. Atgūts no sciencedirect.com.
- Robert Y. Pelgrift, A. J. (2013). Aktuāla hipohlora skābe (HOCl) kā iespējamā nieze. Pašreizējie dermatoloģijas ziņojumi, 2. sējums, 3. numurs, 181. Izgūti no springer.com.
- Karaliskā ķīmijas biedrība. (2015). Hlorhlorskābe. Izgūti no chemspider: chemspider.com.


