Ketonu veidi, īpašības, nomenklatūra, lietošanas veidi un piemēri
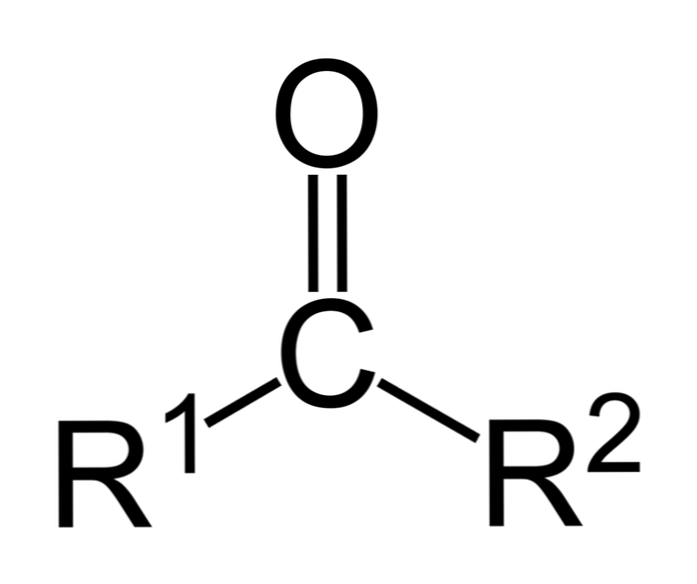
The ketoniem tie ir organiskie savienojumi, kuriem ir karbonilgrupa (-CO). Tie ir vienkārši savienojumi, kuros karbonilgrupas ogleklis ir savienots ar diviem oglekļa atomiem (un to aizvietotāju ķēdēm). Ketoni ir "vienkārši", jo tiem nav reaģējošu grupu, piemēram, -OH vai -Cl, kas pievienots oglekli.
Visbeidzot, ketonu izvadīšana no cilvēka ķermeņa parasti ir saistīta ar zemu cukura līmeni (diabēta gadījumos un / vai ārkārtīgi badošanās), kas var izraisīt nopietnas veselības problēmas pacientam..
Indekss
- 1 Ketonu vispārējā formula
- 2 Ketonu veidi
- 2.1 Atbilstoši jūsu ķēdes struktūrai
- 2.2 Saskaņā ar tās radikāļu simetriju
- 2.3. Atkarībā no tās radikāļu piesātinājuma
- 2.4 Dicetoni
- 3 Ketonu fizikālās un ķīmiskās īpašības
- 3.1. Viršanas punkts
- 3.2 Šķīdība
- 3.3. Skābums
- 3.4. Reaktivitāte
- 4 Nomenklatūra
- 5 Starpība starp aldehīdiem un ketoniem
- 6 Izmanto rūpniecisko un ikdienas dzīvi
- 7 Ketonu piemēri
- 7.1. Butanons (C4H8O)
- 7.2. Cikloheksanons (C6H10O)
- 7.3. Testosterons (C19H22O2)
- 7.4 Progesterons (C21H30O2)
- 8 Atsauces
Ketonu vispārējā formula
Ketoni ir karbonil savienojumi, kuros šī grupa ir saistīta ar divām ogļūdeņražu grupām; tie var būt alkilgrupas, benzola gredzenu grupas vai abas.
Ketonu var vienkārši attēlot kā R- (C = O) -R ', kur R un R' ir jebkuras divas ogļūdeņražu ķēdes (alkāni, alkēni, alkīni, cikloalkāni, benzola atvasinājumi un citi). Nav karbonātu ar ūdeņradi, kas pievienota karbonilgrupai.
Ir plašas metodes ketonu sagatavošanai rūpnieciskajā un laboratorijas vidē; Turklāt ir svarīgi atzīmēt, ka ketonus var sintezēt dažādi organismi, tostarp cilvēki.
Rūpniecībā visplašākā ketonu sintēzes metode ietver ogļūdeņražu oksidēšanos, parasti ar gaisa izmantošanu. Nelielā mērogā ketonus parasti gatavo, oksidējot sekundāros spirtus, kas kā produktus veido ketonu un ūdeni..
Papildus šīm visizplatītākajām metodēm ketonus var sintezēt ar alkēniem, alkīniem, slāpekli saturošiem savienojumiem, esteriem un daudziem citiem savienojumiem, kas padara tos viegli iegūtus..
Ketonu veidi
Ketoniem ir vairākas klasifikācijas, galvenokārt atkarībā no to ķēdes aizstājējiem R. Šīs vielas ir visbiežāk sastopamās klasifikācijas:
Atbilstoši jūsu ķēdes struktūrai
Šajā gadījumā ketons tiek klasificēts pēc tā ķēdes strukturēšanas: alifātiskie ketoni ir tie, kuriem ir divi R un R 'radikāļi, kuriem ir alkilgrupas (alkāni, alkēni, alkīni un cikloalkāni)..
Savukārt aromātiskie savienojumi ir benzola atvasinājumi, kas joprojām ir ketoni. Visbeidzot, jaukti ketoni ir tie, kuriem ir R alkilgrupa un R 'arilgrupa, vai otrādi.
Saskaņā ar tās radikāļu simetriju
Šajā gadījumā tiek pētīti karbonilgrupas radikāļi R un R '; ja tie ir vienādi (identiski), ketonu sauc par simetrisku; bet, ja tie ir atšķirīgi (tāpat kā vairums ketonu), to sauc par asimetrisku.
Saskaņā ar tās radikāļu piesātinājumu
Ketonus var klasificēt arī pēc to oglekļa ķēžu piesātinājuma; Ja tie ir alkānu formā, ketonu sauc par piesātinātu ketonu. Turpretim, ja ķēdes ir atrodamas kā alkēni vai alkīni, ketonu sauc par nepiesātināto ketonu.
Dicetoni
Tā ir atsevišķa ketona klase, jo šī ketona ķēdēm ir divas karbonilgrupas to struktūrā. Dažiem no šiem ketoniem ir unikālas īpašības, piemēram, garāks saiknes garums starp oglēm.
Piemēram, diketoni, kas iegūti no cikloheksāna, ir pazīstami kā hinoni, kas ir tikai divi: orto-benzokinons un para-benzokinons.
Ketonu fizikālās un ķīmiskās īpašības
Ketoni, tāpat kā lielākā daļa aldehīdu, ir šķidras molekulas, un tām ir vairākas fizikālās un ķīmiskās īpašības, kas atšķiras atkarībā no to ķēdes garuma. Tās īpašības ir aprakstītas tālāk:
Viršanas punkts
Ketoni ir ļoti gaistoši, ļoti polāri, un tie nevar ziedot ūdeņraža saitēm (tie nesatur ūdeņraža atomus, kas saistīti ar karbonilgrupu), tāpēc tiem ir augstāks viršanas punkts nekā alkēniem un ēteriem, bet tie ir zemāki nekā spirti ar vienādu molekulmasu.
Ketona viršanas punkts palielinās, palielinoties molekulas lielumam. Tas ir saistīts ar van der Waals spēku un dipola-dipola spēku iejaukšanos, kam nepieciešama lielāka enerģija, lai atdalītu molekulai piesaistītos atomus un elektronus..
Šķīdība
Ketonu šķīdība daļēji būtiski ietekmē šo molekulu spēju pieņemt ūdeņražus skābekļa atomos un tādējādi veidot ūdeņraža saiti ar ūdeni. Turklāt starp ketoniem un ūdeni veidojas pievilcīgi, izkliedēti un dipola-dipola spēki, kas palielina to šķīstošo iedarbību..
Ketoni zaudē šķīdības spēju, jo lielākas ir to molekulas, jo tās sāk prasīt vairāk enerģijas, lai izšķīdinātu ūdenī. Tās arī šķīst organiskos savienojumos.
Skābums
Pateicoties karbonilgrupai, ketoniem ir skābes raksturs; tas notiek tāpēc, ka šīs funkcionālās grupas rezonanses stabilizēšanas spēja var pārnest protonus no dubultās saites, lai izveidotu konjugātu bāzi, ko sauc par enolu..
Reaktivitāte
Ketoni ir daļa no daudzām organiskām reakcijām; tas notiek sakarā ar tā karboniloglekļa jutību pret nukleofilo pievienošanos, papildus šīs polaritātes klātbūtnei..
Kā minēts iepriekš, ketonu augstā reaktivitāte padara tos par atzītu starpproduktu, kas kalpo par pamatu citu savienojumu sintezēšanai.
Nomenklatūra
Ketoni ir nosaukti saskaņā ar karbonilgrupas prioritāti vai nozīmi visā molekulā, tāpēc, ja jums ir molekula, ko regulē karbonilgrupa, ketons tiek nosaukts, pievienojot sufiksu "-on" ogļūdeņraža nosaukumam..
Vislielākā ķēde ar karbonilgrupu tiek uzskatīta par galveno ķēdi, un pēc tam molekula ir nosaukta. Ja karbonilgrupai nav prioritātes pār citām molekulas funkcionālajām grupām, tad to identificē ar "-oxo"..
Sarežģītākiem ketoniem funkcionālās grupas atrašanās vietu var identificēt ar skaitli, un diketonu gadījumā (ketoni ar diviem identiskiem R un R 'aizvietotājiem) tiek nosaukta molekula ar sufiksu "-dione"..
Visbeidzot, vārdu "ketons" var izmantot arī pēc tam, kad ir identificētas ar karbonilgrupu pievienotās radikāļu ķēdes.
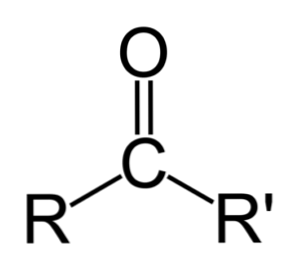
Starpība starp aldehīdiem un ketoniem
Lielākā atšķirība starp aldehīdiem un ketoniem ir ūdeņraža atoms, kas ir pievienots karbonilgrupai aldehīdos..
Šis atoms ir svarīgs efekts, kad tiek iesaistīta molekula oksidācijas reakcijā: aldehīds veidos karboksilskābi vai karboksilskābes sāli atkarībā no tā, vai oksidācija notiek skābos vai pamatnosacījumos..
Turpretim ketonam nav šī ūdeņraža, tāpēc oksidēšanai nepieciešamie minimālie soļi nenotiek.
Ir metodes, lai oksidētu ketonu (ar daudz spēcīgākiem oksidētājiem nekā tie, ko parasti lieto), bet tie izjauc ketona molekulu, vispirms atdalot to divās vai vairākās daļās..
Izmanto rūpniecisko un ikdienas dzīvi
Nozarē ketonus bieži novēro smaržās un krāsās, veicot stabilizatoru un konservantu lomu, kas novērš citu maisījuma sastāvdaļu noārdīšanos; tiem ir arī plašs spektrs kā šķīdinātāji tajās nozarēs, kas ražo sprāgstvielas, krāsas un tekstilizstrādājumus papildus farmaceitiskajiem produktiem.
Acetons (mazākais un vienkāršākais ketons) ir visā pasaulē pazīstams šķīdinātājs, un to lieto kā krāsas noņēmēju un šķīdinātāju..
Dabā ketoni var parādīties kā cukuri, ko sauc par ketozēm. Ketozes ir monosaharīdi, kas satur vienu ketonu uz vienu molekulu. Vispazīstamākā ketoze ir fruktoze, augļi un medus.
Tauku skābju biosintēze, kas notiek dzīvnieku šūnu citoplazmā, notiek arī ar ketonu iedarbību. Visbeidzot, kā minēts iepriekš, var būt ketonu līmeņa paaugstināšanās asinīs pēc badošanās vai diabēta gadījumos.
Ketonu piemēri
Butanons (C4H8O)
To sauc arī par MEK (vai MEC), šis šķidrums tiek ražots lielā mērogā rūpniecībā un tiek izmantots kā šķīdinātājs.
Cikloheksanons (C6H10O)
Šis ketons tiek izmantots kā sintētiskā neilona materiāla prekursors.
Testosterons (C. \ T19H22O2)
Tas ir galvenais vīriešu dzimuma hormons un anaboliskais steroīds, kas atrodams vairumā mugurkaulnieku.
Progesterons (C) |21H30O2)
Endogēnais steroīds un dzimumhormons, kas iesaistīts menstruālā cikla, grūtniecības un embriogenēzē cilvēkiem un citām sugām.
Atsauces
- Vikipēdija. (s.f.). Ketons Izgūti no en.wikipedia.org
- Britannica, E. (s.f.). Ketons Izgūti no britannica.com
- Universitāte, M. S. (s.f.). Aldehīdi un ketoni. Izgūti no chemistry.msu.edu
- ChemGuide. (s.f.). Ieviešot aldehīdus un ketonus. Izgūti no chemguide.co.uk
- Calgary, U. O. (s.f.). Ketoni. Saturs iegūts no chem.ucalgary.ca


