Butino struktūra, īpašības un izmantošanas veidi
The butino ir ķīmisks savienojums, kas pieder pie alkīnu grupas, kas raksturīgs galvenokārt ar to, ka tās struktūra ir vismaz trīs saite starp diviem oglekļa atomiem..
IUPAC (Starptautiskā Tīras un lietišķās ķīmijas savienības akronīms angļu valodā) nosaka, ka tie ir tādi paši kā alkēniem..

Būtiska atšķirība starp abu veidu vielu nomenklatūru ir tāda, ka sufikss -one tiek mainīts uz-vai, kad runa ir par savienojumiem, kuriem ir trīskāršās saites tās struktūrā.
No otras puses, butīno sastāv tikai no oglekļa un ūdeņraža, un tas nāk divos veidos: 1-butīns, kas ir gāzveida fāzē standarta spiediena un temperatūras apstākļos (1 atm, 25 ° C); un 2-butīno, kas ir ķīmiskās sintēzes rezultātā radīta šķidrās fāzes suga.
Indekss
- 1 Ķīmiskā struktūra
- 1.1 1-butino
- 1.2 2-butīns
- 2 Rekvizīti
- 3 Lietojumi
- 4 Atsauces
Ķīmiskā struktūra
Molekulā, kas pazīstama kā butino, tiek attēlota pozīcijas strukturālās izomerizācijas parādība, kas sastāv no vienas un tās pašas funkcionālās grupas klātbūtnes abos savienojumos, bet katra no tām atrodas citā ķēdes vietā..
Šajā gadījumā abām butino formām ir identiska molekulārā formula; tomēr 1-butīnam trīskāršā saite atrodas pirmajā vietā, bet 2-butīnā - otrajā. Tas pārvērš tos pozīcijas izomēros.
Sakarā ar trīskāršās saites atrašanās vietu vienā no 1-butīna struktūras galiem, to uzskata par terminālo alkīnu, bet trīskāršās saites vidus stāvoklis 2-butīna struktūrā dod tai iekšējās alkīna klasifikāciju..
Tādējādi saite var būt tikai starp pirmo un otro oglekli (1-butīnu) vai starp otro un trešo oglekli (2-butīnu). Tas ir saistīts ar piemēroto nomenklatūru, kurā vienmēr tiek dota iespējami zemākā numerācija trīskāršās obligācijas pozīcijai.
1-butino
Savienojums, ko sauc par 1-butīnu, ir pazīstams arī kā etilacetilēns, jo tā struktūra un veids, kādā ir izvietoti un savienoti četri oglekļa atomi. Tomēr, runājot par to butino ir atsauce tikai uz šo ķīmisko sugu.
Šajā molekulā trīskāršā saite atrodama terminālajā oglekļa dioksīdā, kas ļauj iegūt ūdeņraža atomus, kas dod tai lielu reaktivitāti..
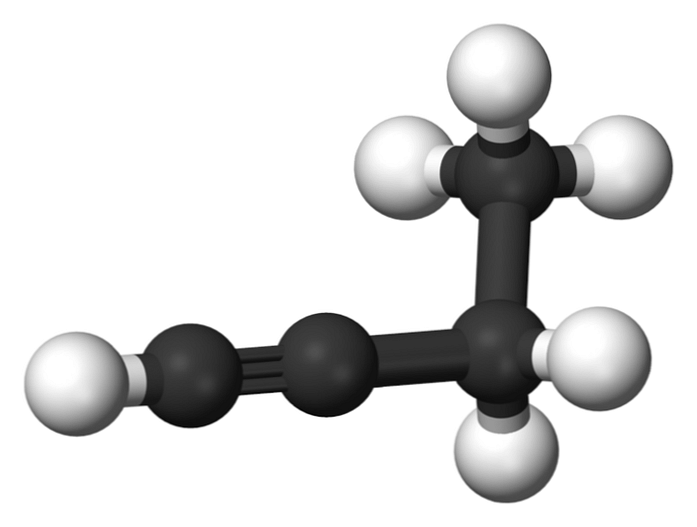
Šī stingra un spēcīgāka saikne nekā viena vai divkāršā saite starp oglekļa atomiem nodrošina stabilu 1-butīna lineārās ģeometrijas konfigurāciju.
No otras puses, šī gāzveida viela ir diezgan uzliesmojoša, tāpēc siltuma klātbūtnē tā var viegli izraisīt ugunsgrēkus vai sprādzienus, un tai ir liela reaktivitāte gaisa vai ūdens klātbūtnē..
2-butīns
Tā kā iekšējiem alkīniem ir lielāka stabilitāte nekā terminālajiem alkīniem, tie ļauj pārveidot 1-butīnu uz 2-butīnu.
Šī izomerizācija var notikt, karsējot 1-butīnu bāzes (piemēram, NaOH, KOH, NaOCH3 ...) klātbūtnē vai pārkārtojot 1-butīnu kālija hidroksīda (KOH) šķīdumā etanolā (C2H6O).
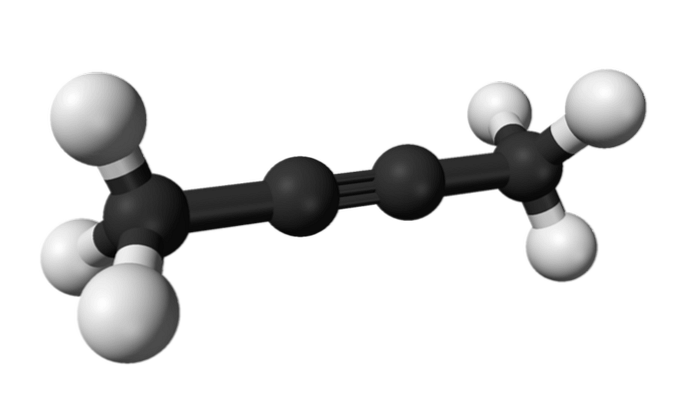
Tāpat ķīmisko vielu, kas pazīstama kā 2-butīns, sauc arī par dimetilacetilēnu (vai krotonilēnu), veidojot sevi kā šķidru un gaistošu sugu, kas mākslīgi radusies..
2-butīnā trīskāršā saite ir molekulas vidū, dodot tai lielāku stabilitāti nekā tā izomērs.
Turklāt šim bezkrāsainam savienojumam ir mazāks blīvums nekā ūdenim, lai gan to uzskata par nešķīstošu un tam ir augsta uzliesmojamība.
Rekvizīti
-Butino strukturālā formula (neatkarīgi no tā, uz kuru izomēru atsaucas) ir C4H6, kurai ir lineāra struktūra.
-Viena no ķīmiskajām reakcijām, ko cieta butīna molekula, ir izomerizācija, kurā molekulā notiek trīskāršās saites pārkārtošanās un migrācija..
-1-Butyne atrodas gāzes fāzē, ir ļoti augsta uzliesmojamība un augstāks blīvums nekā gaisam.
-Šī viela ir arī diezgan reaktīva, un siltuma klātbūtnē var rasties vardarbīgi sprādzieni.
-Turklāt, ja šai bezkrāsainam gāzei rodas nepilnīga sadegšanas reakcija, tas var izraisīt oglekļa monoksīdu (CO).
-Ja abi izomēri ir pakļauti augstai temperatūrai, tie var saskarties ar sprādzienbīstamām polimerizācijas reakcijām.
-2-butīns atrodas šķidrā fāzē, lai gan to parasti uzskata par viegli uzliesmojošu standarta spiediena un temperatūras apstākļos.
-Šīs vielas var piedzīvot vardarbīgas reakcijas, ja tās atrodas spēcīgu oksidējošu vielu klātbūtnē.
-Tādā pašā veidā eksotermiskas reakcijas ar sekojošu gāzveida ūdeņraža izdalīšanos rodas, kad ir reduktīvās sugas..
-Ja tie nonāk saskarē ar noteiktiem katalizatoriem (piemēram, dažām skābām vielām) vai starta sugām, var rasties eksotermiskas polimerizācijas reakcijas..
Lietojumi
Tā kā tiem ir atšķirīgas īpašības, abiem izomēriem var būt dažādi izmantošanas veidi un pielietojumi, kā parādīts zemāk:
Pirmkārt, ļoti bieži viens no 1-butīno izmantošanas veidiem ir tā izmantošana kā starpposms citu organiskas dabas vielu ražošanas procesā..
No otras puses, šī ķīmiskā viela tiek izmantota gumijas un atvasinātu savienojumu ražošanas nozarē; piemēram, ja vēlaties saņemt benzolu.
Tāpat to izmanto daudzu plastmasas izstrādājumu ražošanas procesā, kā arī daudzu polietilēna vielu ražošanā, ko uzskata par augstu blīvumu..
Arī 1-butīns bieži tiek izmantots kā sastāvdaļa dažu metālu sakausējumu, tai skaitā tērauda (dzelzs sakausējuma un oglekļa) griešanai un metināšanai..
Citā ziņā 2-butīna izomēru lieto kombinācijā ar citu alkīnu, ko sauc par propīnu, dažu vielu, ko sauc par alkilētiem hidrokinoniem, sintēzē, kad tiek veikta a-tokoferola (E vitamīna) pilnīgas sintēzes process.
Atsauces
- Vikipēdija. (s.f.). Butyne Izgūti no en.wikipedia.org
- Yoder, C. H., Leber P. A. un Thomsen, M. W. (2010). Tilts uz organisko ķīmiju: jēdzieni un nomenklatūra. Izgūti no books.google.co.ve
- Study.com. (s.f.). Butyne: strukturālā formula un izomēri. Iegūti no pētījuma.
- PubChem. (s.f.). 1-Butyne. Izgūti no pubchem.ncbi.nlm.nih.gov
- PubChem. (s.f.). 2-Butyne. Izgūti no pubchem.ncbi.nlm.nih.gov


