Ķīmisko vienādojumu metožu un paraugu līdzsvarošana
The ķīmisko vienādojumu līdzsvarošana nozīmē, ka visiem elementiem, kas atrodas minētajā vienādojumā, ir vienāds atomu skaits katrā pusē. Lai to panāktu, ir nepieciešams izmantot balansēšanas metodes, lai piešķirtu stehiometriskos koeficientus, kas ir piemēroti katrai reakcijai piederošajai sugai..
Ķīmiskais vienādojums ir tas, kas ar simbolu palīdzību tiek attēlots ķīmiskās reakcijas gaitā starp divām vai vairākām vielām. Reaģenti mijiedarbojas viens ar otru un, atkarībā no reakcijas apstākļiem, kā produkts tiks iegūts viens vai vairāki atšķirīgi savienojumi..
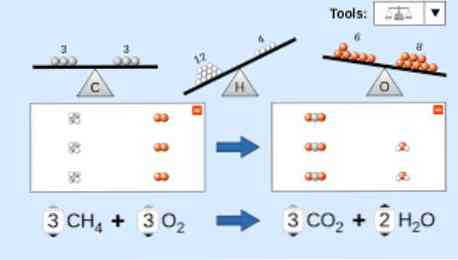
Aprakstot ķīmisko vienādojumu, jāņem vērā sekojošais: Pirmkārt, reaģenta vielas tiek uzrakstītas vienādojuma kreisajā pusē, kam seko vienvirziena bultiņa vai divas pretējās horizontālās bultiņas atkarībā no veicamās reakcijas veida. apmetnis.
Indekss
- 1 Ķīmisko vienādojumu līdzsvarošanas metodes
- 1.1 Ķīmisko vienādojumu līdzsvars pēc izmēģinājuma un kļūdas (ko sauc arī par pārbaudi vai izmēģinājumu)
- 1.2 Ķīmisko vienādojumu algebriskā balansēšana
- 1.3. Redoksu vienādojumu (jonu elektronu metode) velmēšana
- 2 Balansēšanas ķīmisko vienādojumu piemēri
- 2.1 Pirmais piemērs
- 2.2 Otrais piemērs
- 2.3 Trešais piemērs
- 3 Atsauces
Ķīmisko vienādojumu līdzsvarošanas metodes
Pamatojoties uz to, ka reaģenti un produkti ir zināmi un ka to formulas ir pareizi izteiktas pusē, kas tiem atbilst, mēs turpinām līdzsvarot vienādojumus saskaņā ar šādām metodēm..
Ķīmisko vienādojumu līdzsvarošana ar izmēģinājumiem un kļūdām (ko sauc arī par pārbaudi vai izmēģinājumu)
Tas balstās uz reakcijas stehiometriju un mēģina izmēģināt ar dažādiem koeficientiem, lai līdzsvarotu vienādojumu, ja vien tiek izvēlēti mazākie iespējamie veseli skaitļi, ar kuriem katram elementam tiek iegūts vienāds atomu skaits abās pusēs reakcijas.
Reaģenta vai produkta koeficients ir skaitlis, kas ir pirms tā formulas, un tas ir vienīgais skaitlis, ko var mainīt, līdzsvarojot vienādojumu, jo formulu apakškategoriju mainīšana mainītu savienojuma identitāti. attiecīgais jautājums.
Skaitīt un salīdzināt
Pēc katra reakcijas elementa identificēšanas un ievietošanas pareizajā pusē mēs turpinām skaitīt un salīdzināt katra vienādojumā esošā elementa atomu skaitu un noteikt tos, kuriem jābūt līdzsvarotiem.
Tad mēs turpinām katra elementa balansēšanu (pa vienam), novietojot veselus koeficientus pirms katras formulas, kurā ir nelīdzsvaroti elementi. Parasti metāla elementi vispirms ir līdzsvaroti, pēc tam nemetāliskie elementi un visbeidzot skābekļa un ūdeņraža atomi.
Šādā veidā katrs koeficients reizina visus iepriekšminētās formulas atomus; tāpēc, līdzsvarojot elementu, citi var izlīdzināties, bet tas tiek izlabots, kad reakcija ir līdzsvarota.
Visbeidzot, to apstiprina pēdējais skaitlis, ka viss vienādojums ir pareizi līdzsvarots, tas ir, ka tas pakļaujas materiāla saglabāšanas likumam.
Ķīmisko vienādojumu algebriskā balansēšana
Lai izmantotu šo metodi, tiek izveidota procedūra, lai apstrādātu ķīmisko vienādojumu koeficientus kā nezināmas sistēmas, kas jārisina..
Pirmkārt, par atsauci tiek ņemts īpašs reakcijas elements, un koeficienti tiek ievietoti kā burti (a, b, c, d ...), kas atspoguļo nezināmos, saskaņā ar šī elementa esošajiem atomiem katrā molekulā (ja suga nesatur šo elementu "0").
Pēc pirmā vienādojuma iegūšanas tiek noteikti vienādojumi citiem reakcijā esošajiem elementiem; būs tikpat daudz vienādojumu, kā ir elementi minētajā reakcijā.
Visbeidzot, nezināmie ir noteikti ar vienu no algebrisko samazināšanas, izlīdzināšanas vai aizvietošanas metodēm un iegūst koeficientus, kas dod pareizu līdzsvaru.
Līdzsvarošanas redoksu vienādojumi (jonu elektronu metode)
Vispirms vispārējā (nelīdzsvarotā) reakcija tiek ievietota tās jonu formā. Tad šis vienādojums ir sadalīts divās pusreakcijās, oksidācijā un samazinājumā, katrs balansējot atkarībā no atomu skaita, to veida un maksas..
Piemēram, reakcijām, kas rodas skābā vidē, pievieno H molekulas.2Vai līdzsvarot skābekļa atomus un pievienot H+ līdzsvarot ūdeņraža atomus.
Turpretī sārmainā vidē tiek pievienots vienāds skaits OH jonu- par abām pusēm vienādojumam katram H jonam+, un kur rodas joni+ un OH- viņi sanāk kopā, lai veidotu H molekulas2O.
Pievienot elektronus
Pēc tam jums ir jāpievieno tik daudz elektronu, cik nepieciešams, lai līdzsvarotu maksas, pēc tam, kad tas ir līdzsvarots katrā pusreakcijā.
Pēc katras puses reakcijas slīdēšanas tās tiek pievienotas un beidzas, līdzsvarojot galīgo vienādojumu ar izmēģinājumu un kļūdu. Ja divu pusreakciju elektronu skaits ir atšķirīgs, viens vai abi ir jāreizina ar koeficientu, kas vienāds ar šo skaitli.
Visbeidzot, ir jāapstiprina, ka vienādojums ietver tādu pašu atomu skaitu un tā paša veida atomus, turklāt tam ir vienādas maksas abās globālās vienādojuma pusēs..
Ķīmisko vienādojumu līdzsvarošanas piemēri
Pirmais piemērs
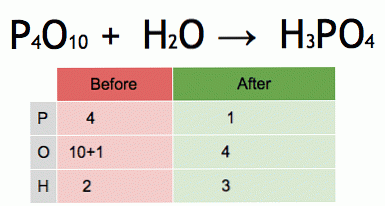
Tas ir līdzsvarota ķīmiskā vienādojuma animācija. Fosfora pentoksīds un ūdens pārvēršas fosforskābē.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
Otrais piemērs
Jums ir etāna sadegšanas reakcija (nesabalansēta).
C2H6 + O2 → CO2 + H2O
Izmantojot līdzsvarošanas metodi, tiek novērots, ka nevienam elementam nav vienāda atomu skaita abās vienādojuma pusēs. Tādējādi tas sākas ar oglekļa bilanci, pievienojot divus kā stehiometrisku koeficientu, kas tam pievienots produktu pusē..
C2H6 + O2 → 2CO2 + H2O
Ogleklis ir sabalansēts abās pusēs, tāpēc mēs turpinām līdzsvarot ūdeņradi, pievienojot ūdens molekulai trīs.
C2H6 + O2 → 2CO2 + 3H2O
Visbeidzot, tā kā vienādojuma labajā pusē ir septiņi skābekļa atomi un tas ir pēdējais līdzsvarotais elements, frakcionālais skaitlis 7/2 tiek novietots skābekļa molekulas priekšā (lai gan parasti ir vēlams izmantot visus koeficientus)..
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Pēc tam pārbaudiet, vai katrā vienādojuma pusē ir vienāds skaits oglekļa atomu (2), ūdeņraža (6) un skābekļa (7).
Trešais piemērs
Dzelzs oksīdēšanās ar dikromāta joniem notiek skābā vidē (nelīdzsvarota un jonu formā)..
Ticība2+ + Kr2O72- → Ticība3+ + Kr3+
Izmantojot balansēšanas jonu elektronu metodi, tā ir sadalīta divās pusreakcijās.
Oksidācija: Ticība2+ → Ticība3+
Samazināšana: Cr2O72- → Kr3+
Tā kā dzelzs atomi jau ir līdzsvaroti (1: 1), produktu pusē tiek pievienots elektrons, lai līdzsvarotu lādiņu.
Ticība2+ → Ticība3+ + e-
Tagad Cr atomi ir līdzsvaroti, vienādojuma labajā pusē pievienojot divus. Tad, kad reakcija notiek skābā vidē, pievieno septiņas H molekulas.2Vai arī produktu pusē, lai līdzsvarotu skābekļa atomus.
Kr2O72- → 2Cr3+ + 7H2O
Lai līdzsvarotu H atomus, pievieno četrpadsmit H jonus+ reaģentu pusē un pēc materiāla izlīdzināšanas lādiņus sabalansē, pievienojot sešus elektronus vienā pusē.
Kr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Visbeidzot, tiek pievienotas abas pusreakcijas, bet tā kā oksidācijas reakcijā ir tikai viens elektrons, tas viss ir jāreizina ar sešiem.
6Fe2+ + Kr2O72- +14H+ + 6e- → Ticība3+ + 2Cr3+ + 7H2O + 6e-
Visbeidzot, elektroni ir jānovērš abās pasaules jonu vienādojuma pusēs, pārbaudot, vai to lādiņš un materiāls ir pareizi līdzsvaroti.
Atsauces
- Chang, R. (2007). Ķīmija (9. izdevums). McGraw-Hill.
- Hein, M., un Arena, S. (2010). Koledžas ķīmijas pamati. Izgūti no books.google.co.ve
- Tuli, G. D. un Soni, P. L. (2016). Ķīmijas vai ķīmisko vienādojumu valoda. Izgūti no books.google.co.ve
- Speedy Publishing (2015). Ķīmijas vienādojumi un atbildes (Speedy Study Guides). Izgūti no books.google.co.ve


