Ogleklis dabā, kur tas ir atrasts un kā, īpašības, izmanto
The oglekli dabā to var atrast dimanti, eļļa un grafiti, starp daudziem citiem scenārijiem. Šis ķīmiskais elements ieņem sesto vietu periodiskajā tabulā un atrodas horizontālajā rindā vai 2. un 14. ailē. Tas ir nemetālisks un tetravalents; tas ir, jūs varat izveidot 4 kopīgas elektronu vai kovalentu obligāciju ķīmiskās saites.
Ogleklis ir elements ar vislielāko pārpilnību zemes garozā. Šī pārpilnība, tās unikālā daudzveidība organisko savienojumu veidošanā un tās izcilā spēja veidot makromolekulas vai polimērus temperatūrā, kas parasti sastopama uz Zemes, padara to par visu zināmo dzīvības formu kopīgu elementu..

Ogleklis dabā ir ķīmisks elements, nepārklājot grafīta un dimanta formas. Tomēr lielākoties tā tiek kombinēta, veidojot ķīmiskus oglekļa savienojumus, piemēram, kalcija karbonātu (CaCO).3) un citi savienojumi naftas un dabasgāzē.
Tā veido arī vairākus minerālus, piemēram, antracītu, ogles, brūnogles un kūdru. Oglekļa vislielākā nozīme ir tā, ka tā ir tā sauktais "dzīves elements", un tā ir visās dzīvajās organizācijās.
Indekss
- 1 Kur atrodas ogleklis un kādā veidā?
- 1.1. Kristāla formas
- 1.2 Amorfas formas
- 1.3. Nafta, dabasgāze un bitumens
- 2 Fizikālās un ķīmiskās īpašības
- 2.1 Ķīmiskais simbols
- 2.2 Atomu skaits
- 2.3. Fizikālais stāvoklis
- 2.4 Krāsa
- 2.5 Atomu masa
- 2.6 Kušanas punkts
- 2.7 Viršanas punkts
- 2.8 Blīvums
- 2.9 Šķīdība
- 2.10 Elektroniskā konfigurācija
- 2.11 Elektronu skaits ārējā vai valences slānī
- 2.12 Saites jauda
- 2.13 Catenación
- 3 Biogeoķīmiskais cikls
- 3.1 Fotosintēze
- 3.2 Elpošana un sadalīšanās
- 3.3. Ģeoloģiskie procesi
- 3.4 Cilvēka darbības traucējumi
- 4 Lietojumi
- 4.1. Nafta un dabasgāze
- 4.2 Grafīts
- 4.3. Diamond
- 4.4. Antracīts
- 4.5. Akmeņogles
- 4.6. Lignīts
- 4.7 Kūdra
- 5 Atsauces
Kur ir ogleklis un kādā veidā?
Papildus tam, ka tā ir ķīmiskā sastāvdaļa, kas ir kopīga visām dzīves formām, dabā esošā oglekļa sastāvā ir trīs kristāliskas formas: dimants, grafīts un fullerēns..
Ir arī vairākas amorfas ogļu formas (antracīts, lignīts, ogles, kūdra), šķidras formas (eļļas šķirnes) un soda (dabasgāze).
Kristāla formas
Kristāliskajās formās oglekļa atomi savienojas, veidojot sakārtotus modeļus ar ģeometrisko telpisko izkārtojumu.
Grafīts
Tā ir mīksta, melna krāsa ar spīdumu vai metāla spīdumu un izturīga pret karstumu (ugunsizturīga). Tās kristāliskajā struktūrā ir oglekļa atomi, kas savienoti sešstūrajos gredzenos, kas savukārt apvieno veidojošās loksnes.
Grafīta nogulsnes ir ierobežotas, un tās ir konstatētas Ķīnā, Indijā, Brazīlijā, Ziemeļkorejā un Kanādā.
Dimants
Tā ir ļoti cieta cieta viela, kas ir caurspīdīga gaismas caurlaidībai un daudz blīvāk nekā grafīts: dimanta blīvuma vērtība ir gandrīz divreiz lielāka par grafīta blīvumu..
Oglekļa atomi dimanta savienojumā ir tetrahēzijas ģeometrijā. Tāpat dimants tiek veidots no grafīta, kas pakļauts ļoti augstām temperatūrām un spiedieniem (3000 ° C) °C un 100 000 atm).
Lielākā daļa dimantu atrodas 140 līdz 190 km dziļumā apmetnē. Ar dziļām vulkāna izvirdumiem magma var transportēt tos līdz attālumiem tuvu virsmai.
Āfrikā ir dimantu lauki (Namībija, Gana, Kongo Demokrātiskā Republika, Sjerraleone un Dienvidāfrika), Amerika (Brazīlija, Kolumbija, Venecuēla, Gajāna, Peru), Okeānija (Austrālija) un Āzija (Indija).

Fulerenos
Tie ir oglekļa molekulārās formas, kas veido 60 un 70 oglekļa atomu klasterus gandrīz sfēriskās molekulās, līdzīgi futbola bumbām..
Pastāv arī fullerēni, kas ir mazāki par 20 oglekļa atomiem. Dažas fullerēnu formas ietver oglekļa nanocaurules un oglekļa šķiedras.

Amorfas formas
Amorfos veidos oglekļa atomi nesavienojas, veidojot sakārtotu un regulāru kristālisku struktūru. Tā vietā tie satur pat piemaisījumus no citiem elementiem.
Antracīts
Tā ir vecākā metamorfā minerālā ogle (kas iegūta, pārveidojot akmeņus ar temperatūras, spiediena vai šķidrumu ķīmiskās iedarbības ietekmi), jo tās veidošanās sākas primārajā vai paleozoiskā laikmetā..
Antracīts ir oglekļa amorfa forma, kurai ir augstāks šī elementa saturs: no 86 līdz 95%. Tas ir pelēks-melns un metālisks spīdums, tas ir smags un kompakts.
Kopumā antracīts atrodams ģeoloģiskās deformācijas apgabalos un veido aptuveni 1% no pasaules ogļu krājumiem.
Ģeogrāfiski tas ir atrodams Kanādā, ASV, Dienvidāfrikā, Francijā, Lielbritānijā, Vācijā, Krievijā, Ķīnā, Austrālijā un Kolumbijā.

Akmeņogles
Tā ir minerālā ogle, organiskas izcelsmes nogulumakmens, kura veidošanās notiek no paleozoikas un mezozoikas laikmetiem. Tā oglekļa saturs ir no 75 līdz 85%.
Tas ir melns, to raksturo nepārredzamība un matēts un taukains izskats, jo tam ir augsts bitumena vielu saturs. To veido lignīta saspiešana paleozoiskā laikmetā, oglekļa un permija periodā.
Tā ir visbiežāk sastopamā ogļu forma uz planētas. Amerikas Savienotajās Valstīs, Lielbritānijā, Vācijā, Krievijā un Ķīnā ir lielas ogļu atradnes.
Lignīts
Tā ir fosilā minerālā ogle, kas terciārajā vecumā veidojas no kūdras ar saspiešanu (augsts spiediens). Tai ir zemāks oglekļa saturs nekā ogļu, no 70 līdz 80%.
Tas ir nedaudz kompakts materiāls, drupans (raksturīgs, kas atšķir to no citiem oglekļa minerāliem), brūns vai melns. Tās struktūra ir līdzīga koksnes tekstūrai un tās oglekļa saturs svārstās no 60 līdz 75%.
Tas ir viegli aizdedzes degviela ar zemu siltumietilpību un zemāku ūdens saturu nekā kūdra.
Vācijā, Krievijā, Čehijā, Itālijā (Veneto reģionos, Toskāna, Umbrija) un Sardīnijā ir nozīmīgas lignīta raktuves. Spānijā lignīta nogulsnes atrodas Astūrijā, Andorā, Zaragozā un La Coruña.
Kūdra
Tas ir organiskas izcelsmes materiāls, kura veidošanās nāk no Kvartāra ēras, kas ir daudz jaunāka par iepriekšējām oglēm.
Tā ir brūngani dzeltena krāsa, un tā parādās kā maza blīvuma poraina masa, kurā jūs varat redzēt augu paliekas no tās izcelsmes vietas.
Atšķirībā no iepriekš minētajām ogām kūdra nav iegūta no koksnes materiāla vai koksnes karbonizācijas procesiem, bet tā ir veidojusies no augu uzkrāšanās - galvenokārt garšaugiem un sūnām - purvainos apgabalos, izmantojot karbonizācijas procesu, kas nav pabeigts..
Kūdrai ir augsts ūdens saturs; šī iemesla dēļ pirms lietošanas ir nepieciešama žāvēšana un saspiešana.
Tam ir zems oglekļa saturs (tikai 55%); tāpēc tam ir zema enerģijas vērtība. Sadedzinot to, pelnu atlikums ir bagātīgs un izdala daudz dūmu.
Čīlē, Argentīnā (Tierra del Fuego), Spānijā (Espinosa de Cerrato, Palencia), Vācijā, Dānijā, Holandē, Krievijā, Francijā ir nozīmīgi kūdras noguldījumi..

Nafta, dabasgāze un bitumens
Eļļa (no latīņu valodas petrae, kas nozīmē "akmens"; un oleums, kas nozīmē "eļļa": "akmens eļļa") ir daudzu organisko savienojumu - lielāko daļu ogļūdeņražu - maisījums, ko iegūst organisko vielu anaerobās baktēriju sadalīšanās dēļ (bez skābekļa)..
Tā veidojās gruntī, lielos dziļumos un īpašos apstākļos gan fiziskā (augsta spiediena un temperatūras), gan ķīmiskā (specifisku katalizatoru savienojumu klātbūtnē) procesā, kas ilga miljoniem gadu..
Šī procesa laikā C un H tika atbrīvoti no organiskajiem audiem un atkal pievienojās rekombinācijai, veidojot milzīgu skaitu ogļūdeņražu, kas sajaukti atbilstoši to īpašībām, veidojot dabasgāzi, eļļu un bitumenu..
Planētas naftas lauki atrodas galvenokārt Venecuēlā, Saūda Arābijā, Irākā, Irānā, Kuveitā, Apvienotajos Arābu Emirātos, Krievijā, Lībijā, Nigērijā un Kanādā..
Krievijā, Irānā, Venecuēlā, Katarā, ASV, Saūda Arābijā un Apvienotajos Arābu Emirātos ir dabasgāzes rezerves, tostarp.
Fizikālās un ķīmiskās īpašības
No oglekļa īpašībām varam pieminēt:
Ķīmiskais simbols
C.
Atomu skaits
6.
Fiziskais stāvoklis
Cieta, normālos spiediena un temperatūras apstākļos (1 atmosfēra un 25 ° C). \ T °C).
Krāsa
Pelēks (grafīts) un caurspīdīgs (dimants).
Atomu masa
12,011 g / mol.
Kušanas punkts
500 °C.
Viršanas punkts
827 °C.
Blīvums
2,62 g / cm3.
Šķīdība
Nešķīst ūdenī, šķīst tetrahloroglekļa CCl4.
Elektroniskā konfigurācija
1s2 2s2 2p2.
Elektronu skaits ārējā slānī vai valencē
4.
Saites jauda
4.
Kārdināšana
Tā spēj veidot ķīmiskus savienojumus garās ķēdēs.
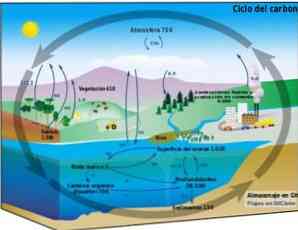
Biogeoķīmiskais cikls
Oglekļa cikls ir cirkulārs bioģeoķīmisks process, ar kura palīdzību var apmainīties ar oglekli starp biosfēru, atmosfēru, hidrosfēru un zemes litosfēru..
Zināšanas par šo ciklisko oglekļa procesu uz Zemes ļauj demonstrēt cilvēka rīcību šajā ciklā un tā sekas uz globālajām klimata pārmaiņām.
Ogleklis var cirkulēt starp okeāniem un citiem ūdenstilpēm, kā arī starp litosfēru, augsni un augsni, atmosfērā un biosfērā. Atmosfērā un hidrosfērā ogleklis atrodas kā CO2 (oglekļa dioksīds).
Fotosintēze
Oglekli atmosfērā uztver ekosistēmu sauszemes un ūdens organismi (fotosintētiskie organismi)..
Fotosintēze ļauj ķīmisko reakciju starp CO2 un ūdeni, ko nodrošina saules enerģija un hlorofils no augiem, lai ražotu ogļhidrātus vai cukurus. Šis process pārveido vienkāršas molekulas ar zemu CO enerģijas saturu2, H2O un skābeklis O2, sarežģītu molekulu molekulās ar augstu enerģiju, kas ir cukuri.
Heterotrofiskie organismi - kas nevar veikt fotosintēzi un kas ir ekosistēmu patērētāji - iegūst oglekli un enerģiju, kad viņi barojas ar ražotājiem un citiem patērētājiem..
Elpošana un sadalīšanās
Elpošana un sadalīšanās ir bioloģiski procesi, kas atbrīvo oglekli uz vidi CO2 vai CH4 (metāns, kas iegūts anaerobā sadalījumā, tas ir, bez skābekļa).
Ģeoloģiskie procesi
Ar ģeoloģiskiem procesiem un laika gaitā anaerobās sadalīšanās oglekli var pārveidot par fosilo kurināmo, piemēram, naftu, dabasgāzi un oglēm. Tāpat ogleklis ir arī citu minerālu un akmeņu daļa.
Cilvēka darbības traucējumi
Kad cilvēks izmanto fosilā kurināmā sadedzināšanu enerģijai, ogleklis atgriežas atmosfērā lielā daudzumā CO2 ko nevar pielīdzināt dabiskajam bioģeoķīmiskajam oglekļa ciklam.
Šis CO pārpalikums2 cilvēka darbības rezultātā negatīvi ietekmē oglekļa cikla līdzsvaru un ir galvenais globālās sasilšanas cēlonis.
Lietojumi
Oglekļa un tā savienojumu izmantošana ir ļoti atšķirīga. Vispilnīgākie šādi:
Nafta un dabasgāze
Galvenais oglekļa izmantojums tiek izmantots kā fosilā kurināmā ogļūdeņradis, piemēram, metāna gāze un nafta..
Eļļa tiek destilēta rafinēšanas rūpnīcās, lai iegūtu vairākus atvasinājumus, piemēram, benzīnu, dīzeļdegvielu, petroleju, asfalta, smērvielas, šķīdinātājus un citus, kas savukārt tiek izmantoti naftas ķīmijas rūpniecībā, kas ražo izejvielas plastmasas, mēslošanas līdzekļu, farmaceitisko līdzekļu un krāsu nozarē. , cita starpā.
Grafīts
Grafīts tiek izmantots šādās darbībās:
- To izmanto zīmuļu ražošanā, sajaucot ar māliem.
- Tā ir daļa no ugunsizturīgo ķieģeļu un tīģeļu ražošanas, kas ir karstumizturīgs.
- Dažādās mehāniskās ierīcēs, tādās kā paplāksnes, gultņi, virzuļi un blīves.
- Tā ir lieliska smērviela.
- Tā elektriskās vadītspējas un ķīmiskās inerences dēļ to izmanto elektrodu, elektromotoru ogļu ražošanā.
- To izmanto kā moderatoru atomelektrostacijās.
Dimants
Diamond ir īpaši izcilas fizikālās īpašības, piemēram, augstāks cietības un siltuma vadītspējas līmenis, kas zināms līdz šim.
Šīs īpašības ļauj rūpnieciskiem pielietojumiem darbarīkos, ko izmanto, lai veiktu izcirtņus un pulēšanas instrumentus, lai nodrošinātu augstu abrazīvo spēku.
Tā optiskās īpašības, piemēram, caurspīdīgums un spēja nojaukt balto gaismu un atstarot gaismu, dod tai daudz pielietojumu optiskos instrumentos, piemēram, lēcu un prizmu ražošanā..
Raksturīgo spilgtumu, kas izriet no tā optiskajām īpašībām, arī ļoti novērtē rotaslietu nozarē.
Antracīts
Antracītam ir aizdegšanās grūtības, lēna dedzināšana un daudz skābekļa. Tās sadegšana rada mazliet gaiši zilas krāsas liesmu un daudz siltuma.
Pirms dažiem gadiem antracīts tika izmantots termoelektrostacijās un mājas apkurei. Tā izmantošanai piemīt tādas priekšrocības kā mazo pelnu vai putekļu ražošana, neliels dūmu daudzums un lēns degšanas process.
Augstās ekonomiskās izmaksas un nepietiekamības dēļ antracīts ir aizstāts ar dabasgāzi termoelektrostacijās un ar elektrību mājās..
Akmeņogles
Akmeņogles tiek izmantotas kā izejvielas, lai iegūtu:
- Kokss, degviela no domnām tērauda rūpnīcās.
- Kreozots, kas iegūts, sajaucot darvas destilātus no akmeņoglēm un ko izmanto kā aizsargājošu materiālu koksnes pakļaušanai laika apstākļiem.
- Kresols (ķīmiski metilfenols), kas iegūts no oglēm un ko izmanto kā dezinfekcijas līdzekli un antiseptisku līdzekli,
- Citi atvasinājumi, piemēram, gāze, darva vai piķis, un savienojumi, ko izmanto smaržu, insekticīdu, plastmasu, krāsu, riepu un ceļu segumu ražošanā, cita starpā.
Lignīts
Lignīts ir vidējas kvalitātes degviela. Džeku, lignīta šķirni raksturo ļoti kompaktais garais karbonizācijas process un augsts spiediens, un to izmanto rotaslietas un rotājumi..
Kūdra
Kūdra tiek izmantota šādās darbībās;
- Augu sugu augšanai, atbalstam un transportēšanai.
- Kā organiskais mēslojums.
- Kā gultas staļļos dzīvnieki.
- Kā zemas kvalitātes degviela.
Atsauces
- Burrows, A., Holman, J., Parsons, A., Pilling, G. un Price, G. (2017). Ķīmija3: neorganiskās, organiskās un fizikālās ķīmijas ieviešana. Oxford University Press.
- Demings, A. (2010). Elementu karalis? Nanotehnoloģija 21 (30): 300201. doi: 10.1088
- Dienwiebel, M., Verhoeven, G., Pradeep, N., Frenken, J., Heimberg, J. un Zandbergen, H. (2004). Grafīta augstspēja. Fiziskās apskates vēstules. 92 (12): 126101. doi: 10.1103
- Irifune, T., Kurio, A., Sakamoto, S., Inoue, T. un Sumiya, H. (2003). Materiāli: Ultrahard polikristālisks dimants no grafīta. Daba 421 (6923): 599-600. doi: 10.1038
- Savvatimskiy, A. (2005). Grafīta kušanas punkta un šķidrā oglekļa īpašību mērījumi (pārskats par 1963.-2003. Gadu). Ogleklis. 43 (6): 1115. doi: 10.1016


