Alumīnija sulfāts (Al2 (SO4) 3) struktūra, lietošanas veidi, toksicitāte
The alumīnija sulfāts ir neorganisks alumīnija sāls ar formulu Al2(SO4)3, kas parasti parādās kā balta cieta viela ar spīdīgiem kristāliem. Savienojuma krāsu ietekmēs dzelzs koncentrācija un jebkurš cits piemaisījums. Ir divi galvenie alumīnija sulfāta veidi: A un B.
Apakšējā attēlā ir attēloti balti alumīnija sulfāta kristāli. Var atzīmēt brūnu krāsu trūkumu, kas norāda uz dzelzs joniem kristāliskajā režģī.

Alumīnija sulfāts ir sāls, kas ļoti labi šķīst ūdenī un dabā tas ir reti sastopams bezūdens formā. Tas parasti ir hidratēts oktadekahidrāta alumīnija sulfāta veidā [Al2(SO4)3.18H2O] vai heksadekahidrāts [Al2(SO4)3.16H2O].
Tāpat tas var veidot dubultus sāļus ar kāliju un ar amonija savienojumiem, kas pazīstami kā alumi. Daļēji tas var būt saistīts ar ūdens afinitāti hidrātos, lai saglabātu citus jonus, izņemot alumīniju.
Alumīnija sulfātu var sadalīt, iedarbojoties ar alumīnija hidroksīdu un sērskābi. Šī īpašība ir ļāvusi izmantot kā augsnes skābinātāju.
Tas ir arī toksisks savienojums, īpaši saskaroties ar pulveri. Tomēr tam ir bezgalīgs lietojums un pielietojumi, kas sākas no ūdens attīrīšanas ar koagulācijas metodi, izmantojot tās izmantošanu vairākās nozarēs, līdz tās lietošanai ar terapeitiskiem mērķiem.
Indekss
- 1 Struktūra
- 2 Kas tas ir (izmanto)
- 2.1 Ūdens koagulācija vai flokulācija
- 2.2. Izmantojiet kā tintes krāsu un papīra izstrādi
- 2.3. Rūpnieciskā izmantošana
- 2.4. Zāļu un terapijas pielietojums
- 2.5 Citi izmantošanas veidi
- 3 Alumīnija sulfāta ražošana
- 4 veidi
- 5 Toksicitāte
- 6 Atsauces
Struktūra
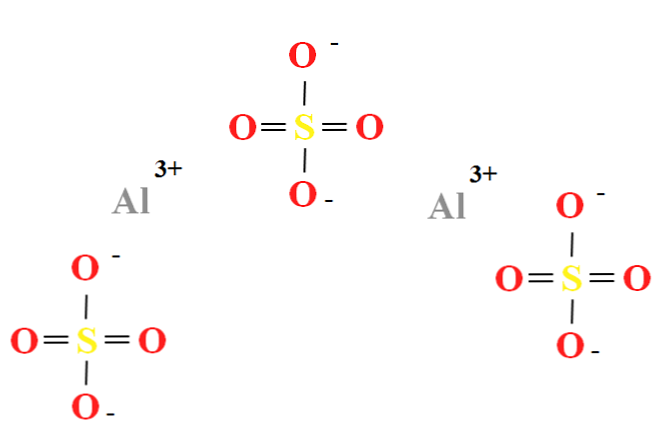
Alumīnija sulfātam ir divu aljonu attiecība3+ par katru triju anjonu SO42- (augšējais attēls), ko var novērot tieši tās ķīmiskajā formā Al2(SO4)3.
Ņemiet vērā, ka Al3+ tie ir pelēcīgi, bet iebildumu paziņojums42- tie ir dzelteni (sēra atoms) un sarkanie (skābekļa atomiem).
Attēlotā struktūra atbilst Al bezūdens formai2(SO4)3, jo neviena ūdens molekula mijiedarbojas ar joniem. Savos hidrātos ūdens tomēr var piesaistīt pozitīvajiem Alas centriem3+, vai ar negatīvu SO tetraedru42- caur ūdeņraža saitēm (HOH-O-SO32-).
Al2(SO4)3∙ 18H2Vai, piemēram, tā satur 18 ūdens molekulas cietajā struktūrā. Daži no tiem var būt tiešā saskarē ar Al3+ vai ar iebildumu paziņojumu42-. Citiem vārdiem sakot: alumīnija sulfātam var būt iekšējs vai ārējs koordinācijas ūdens.
Arī tās struktūra var uzņemt citus katjonus, piemēram, Fe3+, Na+, K+, utt. Bet tam ir nepieciešams vairāk anjonu SO klātbūtnes42-. Ko? Neitralizēt pozitīvo izmaksu pieaugumu, ko rada metālu piemaisījumi.
Alumīnija sulfātam var būt daudz struktūru, lai gan tās hidrāti mēdz pieņemt monoklinisko kristālisko sistēmu.
Fizikālās un ķīmiskās īpašības
Izskats
Tas parādās kā ciets balts kristāls, granulas vai pulveris.
Molekulmasa
342,31 g / mol (bezūdens).
Smarža
Tas ir bez smaržas
Garša
Saldā garša mēreni savelkoša.
Kušanas punkts
770ºC bezūdens forma (86,5ºC oktadekahidrāta forma)
Šķīdība ūdenī
31,2 g / 100 ml pie 0 ° C; 36,4 g / 100 ml 20 ° C temperatūrā un 89 g / 100 ml 100 ° C temperatūrā.
Blīvums
2,67 līdz 2,71 g / cm3.
Šķīdība
Nedaudz šķīst etilspirtā.
Tvaika spiediens
Būtībā nulle.
Stabilitāte
Stabils gaisā.
Sadalīšanās
Karsējot, aptuveni tā kušanas brīdī, tā var sadalīties, emitējot īpaši sēra oksīdu, toksisku gāzi.
Kodīgums
Alumīnija sulfāta šķīdumi ir kodīgi pret alumīniju. Arī savienojums var korozēt metālus mitruma klātbūtnē.
pKa
3.3 līdz 3.6. Un tā pH ir 2,9 vai vairāk 5% ūdens šķīdumā.
Kas tas ir (izmanto)
Ūdens koagulācija vai flokulācija
-Ja sajaucas ar ūdeni (dzeramais, pasniegtais vai atkritumi), alumīnija sulfāts izraisa alumīnija hidroksīdu, kas veido kompleksus ar savienojumiem un šķīduma daļiņām, paātrinot to nogulsnēšanos, kas, ja nav apstrādes ar alumīnija sulfātu ilgu laiku.
-Alumīnija sulfātu izmanto arī peldbaseina ūdens tīrīšanai, padarot tos pievilcīgākus lietošanai.
-Izmantojot alumīnija sulfātu, ūdens tiek iegūts bez duļķainības un krāsas, palielinot tā spēju, veicinot ūdens attīrīšanu. Diemžēl šī attīrīšanas metode var nedaudz palielināt alumīnija koncentrāciju ūdenī.
-Alumīnijs ir ļoti toksisks metāls, kas uzkrājas ādā, smadzenēs un plaušās, izraisot nopietnus traucējumus. Turklāt nav zināms, kādu funkciju tā pilda dzīvajās būtnēs.
-Eiropas Savienība pieprasa, lai maksimālais pieļaujamais alumīnija daudzums ūdenī nepārsniegtu 0,2 mg / l. Tikmēr ASV Vides aizsardzības aģentūra pieprasa, lai maksimālais pieļaujamais ūdens piesārņojums ar alumīniju nepārsniegtu 0,05-0,2 mg / l.
-Notekūdeņu attīrīšana vai lietošana ar alumīnija sulfātu ļauj ekonomiski novērst vai samazināt fosforu.
Izmantojiet kā krāsu tintes un papīra izstrādi
-Alumīnija sulfāts ir izmantots kā krāsvielām vai tintēm, palīdzot nostiprināties krāsojamam materiālam. Tās noteikšanas darbība ir saistīta ar Al (OH)3, kuru želatīna konsistence veicina krāsvielu adsorbciju uz tekstilmateriāliem.
-Lai gan tas ir izmantots kopš 2000. gada pirms mūsu ēras iepriekš aprakstītajam mērķim, tikai organiskām krāsvielām ir nepieciešami sārņi. No otras puses, sintētiskās krāsvielas neprasa, lai sabiezētāji pildītu savas funkcijas.
-Tas ir pārvietots no papīra ražošanas, bet tas joprojām tiek izmantots papīra masas ražošanā. Noņem piemaisījumus, kā arī izmanto materiālus, neitralizē lādiņus un kalibrē kolofonu.
Rūpnieciskais pielietojums
-To izmanto būvniecības nozarē, lai paātrinātu betona uzstādīšanu. Turklāt to izmanto ēku hidroizolācijai.
-Ziepju un tauku rūpniecībā to izmanto glicerīna ražošanā.
-To izmanto naftas rūpniecībā sintētisko katalizatoru ražošanā, kurus izmanto darbības laikā.
-To izmanto farmaceitiskajā rūpniecībā kā stingrāku narkotiku un kosmētikas līdzekļu sagatavošanā.
-Piedalās krāsvielu, piemēram, karmīna, ražošanā. To izmanto arī kā krāsvielu butadiēna stirola sintētisko kaučuku ražošanā.
-Cukura ražošanas nozarē to izmanto kā melases attīrītāju cukurniedru ražošanai.
-To izmanto dezodorantu ražošanā. Kāpēc? Tā kā tas izraisa sviedru dziedzeru cauruļu sašaurināšanos, tādējādi ierobežojot sviedru uzkrāšanos, kas ir nepieciešams līdzeklis baktēriju augšanai, kas izraisa smaku.
-To lieto ādas miecēšanā, nepieciešamajā procesā to izmantošanai. Turklāt to izmanto mēslošanas līdzekļu ražošanā.
-To izmanto kā piedevu krāsu, līmvielu un hermētiķu sagatavošanā, kā arī mēbeļu tīrīšanas un kopšanas līdzekļos..
Zāļu un terapeitiskie lietojumi
-Alumīnija sulfāts ir imunoloģisks adjuvants. Tādēļ tā pilda antigēnu apstrādes funkciju tā, lai, atbrīvojot to darbības vietā, tie iegūtu lielāku antivielu ražošanu antigēniem, kas tika inokulēti..
-Freunda adjuvants un BCG, kā arī citi palīgvielas, tostarp endogēnās vielas, piemēram, interleukīni, nav specifiski antigēniem, kas ļauj palielināt imūnās darbības rādiusu. Tas ir ļāvis izstrādāt vakcīnas pret daudzām slimībām.
-Alumīnija sulfāta koagulējošā darbība ir ļāvusi novērst daudzus vīrusus apstrādātajā ūdenī, cita starpā: Q beta, MS2, T4 un P1. Rezultāti liecina, ka ūdens apstrāde ar alumīnija sulfātu rada šādu vīrusu inaktivāciju.
-Alumīnija sulfātu lieto nūju vai pulvera veidā mazu virspusēju brūču vai nobrāzumu ārstēšanā, kas rodas skūšanās laikā.
-To lieto alumīnija acetāta, savienojuma, ko izmanto dažu ausu apstākļu ārstēšanai, ražošanā. Tas arī ir ticis izmantots bez ievērojamiem panākumiem, lai mazinātu ugunsgrēka skudru bojājumu sekas..
-Alumīnija sulfāta šķīdumi tiek izmantoti 5 līdz 10% koncentrācijā čūlu lokālā ārstēšanā, kas ļauj kontrolēt to sekrēciju..
-Alumīnija sulfāta savelkošā iedarbība sedz ādas virsmas slāņus, koagulē proteīnus un dziedē brūces..
Citi izmantošanas veidi
-Alumīnija sulfāts palīdz kontrolēt pārmērīgu aļģu augšanu dīķos, ezeros un ūdens plūsmās. To izmanto arī mīkstmiešu izņemšanai, tostarp spāņu lode.
-Dārznieki izmanto šo savienojumu, lai paskābinātu sārmainās augsnes. Saskaroties ar tā ūdeni, alumīnija sulfāts tiek sadalīts alumīnija hidroksīdā un atšķaidītā sērskābē. Tad alumīnija hidroksīds nogulsnē, atstājot sērskābi šķīdumā.
-Augsnes paskābināšanās sērskābes dēļ vizualizējas ļoti radošā veidā, jo pastāv augs, ko sauc par Hortenziju, kura ziedi kļūst zili, skābās augsnes klātbūtnē; tas ir, tie ir jutīgi un reaģē uz pH izmaiņām.
-Alumīnija sulfāts ir iesaistīts putu ražošanā, lai apkarotu un kontrolētu uguni. Kā? Reaģē ar nātrija bikarbonātu, radot CO izdalīšanos2. Šī gāze bloķē O piekļuvi2 materiāla sadegšanas vietā; un līdz ar to pamieru, kas attīstījās.
Alumīnija sulfāta ražošana
Alumīnija sulfātu sintezē, alumīnija bagātu savienojumu, piemēram, boksīta rūdu, reaģējot ar sērskābi paaugstinātā temperatūrā. Reakcija ir šāda ķīmiskā vienādojuma:
Al2O3 + H2SO4 -> Al2(SO4)3 + 3 H2O
Alumīnija sulfātu var veidot arī ar neitralizācijas reakciju starp alumīnija hidroksīdu un sērskābi saskaņā ar šādu reakciju:
2 Al (OH)3 + 3 H2SO4 + 12 H2O -> Al2(SO4)3.18H2O
Sērskābe reaģē ar alumīniju, veidojot amonija sulfātu un izdalot ūdeņraža molekulas gāzes veidā. Reakcija ir shematiska šādi:
2 Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
Veidi
Alumīnija sulfātu iedala divos veidos: A un B tipa. A tipa alumīnija sulfātā cietvielas ir baltas, un to dzelzs koncentrācija ir mazāka par 0,5%..
B tipa alumīnija sulfātā cietvielas ir brūnas un dzelzs koncentrācija ir mazāka par 1,5%..
Ir nozares, kas ražo alumīnija sulfātu, kam ir atšķirīgi kritēriji to klasifikācijai. Tādējādi nozare ziņo par A tipa alumīnija sulfāta sagatavošanu, kuras maksimālā koncentrācija ir dzelzs kā dzelzs oksīds. Lai gan B tipam tās norāda uz maksimālo dzelzs koncentrāciju 0,35%..
Toksicitāte
-Alumīnija sulfāts ir savienojums, kas iedarbojas uz toksisko iedarbību, nonākot saskarē ar putekļiem, tādējādi izraisot ādas kairinājumu un gadījumos, kad saskare ir bieža, dermatīts..
-Acīs tas rada spēcīgu kairinājumu, pat radot pastāvīgus ievainojumus.
-Ieelpošana izraisa deguna un rīkles kairinājumu, kas var izraisīt klepu un izsitumus.
-Tās lietošana izraisa kuņģa kairinājumu, sliktu dūšu un vemšanu.
-Ir toksiskas sekas, ka, lai gan tās nav tieši saistītas ar alumīnija sulfātu, tās ir netieši saistītas ar to izmantošanu. Tas attiecas uz dažām alumīnija toksiskām sekām, ko izraisa alumīnija sulfāta izmantošana ūdens attīrīšanā.
-Pacientiem, kuri hroniski dializē, izmantojot sāļus, kas pagatavoti attīrītā ūdenī, izmantojot alumīnija sulfātu, ir ļoti smagi veselības traucējumi. Starp šiem traucējumiem ir anēmija, dialīze un kaulu slimību palielināšanās.
Atsauces
- Vikipēdija. (2018). Alumīnija sulfāts Uzņemts no: en.wikipedia.org
- Aris Industrial A un B tipa alumīnija sulfāta šķīdums. No: aris.com.pe
- Christopher Boyd (2014. gada 9. jūnijs). Top alumīnija sulfāta rūpnieciskie pielietojumi. No: chemservice.com
- PubChem. (2018). Bezūdens alumīnija sulfāts. Uzņemts no: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals (2009. gada 20. augusts). Alumīnija sulfāta drošības loksne. [PDF] No: andesia.com
- Ķīmiskā grāmata. (2017). Alumīnija sulfāts. Uzņemts no: chemicalbook.com


