Kalcija hidrīda (CaH2) īpašības, reaktivitāte un pielietojums
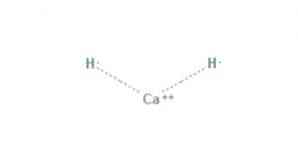
The kalcija hidrīds ir ķīmisks savienojums ar formulu CaH2, kas padara to par sārmu zemes hidrīdu. Šim ķīmiskam savienojumam ir divas jonu saites starp kalciju un diviem hidrīda joniem, kā parādīts 1. attēlā.
Tas ir sālsūdens hidrīds, kas nozīmē, ka tā struktūra ir līdzīga sālim. Tā kristāliskā struktūra ir tāda pati kā svina hlorīda (Cotunnite minerālu) struktūra, kā parādīts 2. attēlā.

Visi sārmu un sārmzemju metāli veido hidrīda sāļus. Ķīmijā hidrīds ir ūdeņraža anjons, H- vai, biežāk, savienojums, kurā vienam vai vairākiem ūdeņraža centriem ir nukleofīlas, reducējošas vai pamata īpašības..
Savienojumos, kas tiek uzskatīti par hidrīdiem, ūdeņraža atoms ir pievienots vairāk elektropozitīvam elementam vai grupai.
To var ražot, kalciju un ūdeņradi reaģējot temperatūrā no 300 līdz 400 grādiem pēc Celsija. Vēl viens veids, kā sagatavot kalcija hidrīdu, ir kalcija hlorīda sildīšana kopā ar ūdeņradi un nātrija metālu. Reakcija notiek šādi:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Šajā reakcijā kalcija (Ca) un ūdeņradis (H) veido kalcija hidrīda molekulu, bet nātrija atomi kopā ar hloru veido nātrija hlorīda (NaCl) molekulas..
Kalcija hidrīdu var ražot, samazinot kalcija oksīdu (CaO) ar magniju (Mg). Reakcija tiek veikta ūdeņraža klātbūtnē. Šī reakcija rada arī magnija oksīdu (MgO). Zemāk ir šīs ķīmiskās reakcijas formula:
CaO + Mg + H2 → CaH2 + MgO
Indekss
- 1 Kalcija hidrīda fizikālās un ķīmiskās īpašības
- 2 Reaktivitāte un bīstamība
- 3 Lietošana un uzglabāšana
- 4 Lietojumi un lietojumprogrammas
- 4.1. Žāvēšanas līdzeklis
- 4.2. Ūdeņraža ražošana
- 4.3. Reduktors
- 5 Trūkums kalcija hidrīda lietošanā
- 6 Atsauces
Kalcija hidrīda fizikālās un ķīmiskās īpašības
Kalcija hidrīds ir kristālu kopums ar baltu ororhombisku struktūru, ja tā ir tīra. Parasti tas ir reti sastopams šādā formā, tāpēc parasti tam ir pelēks nokrāsojums. Tam nav raksturīgas smaržas. Tās izskats parādīts 3. attēlā (Royal Society of Chemistry, 2015).

Tā molekulmasa ir 42,094 g / mol, tās kušanas temperatūra ir 816 grādi pēc Celsija un blīvums 1,70 g / ml. Ja tas izšķīst ūdenī, tas reaģē uz spēcīgu ūdeņradi. Tā arī reaģē ar alkoholu (Nacionālais biotehnoloģijas informācijas centrs., S.F.).
Reaktivitāte un apdraudējumi
Kalcija hidrīds ir stabila ķīmiskā viela, lai gan tā ir ļoti reaktīva pret ūdeni vai mitrumu. Saskaroties ar ūdeni, tā izdala uzliesmojošas ūdeņraža gāzes, kas spontāni var aizdegties.
To uzskata par sprāgstvielu. Karsējot reakcijā ar tetrahidrofurānu, tas var izraisīt eksploziju. Sajaucot ar hlorātu, hipohlorītu, bromātu, kālija perhlorātu, tā kļūst jutīga pret karstumu, berzi un kļūst sprādzienbīstama (Kalcija hidrīds 7789-78-8, 2016).
Kad sudraba fluorīds tiek sasmalcināts ar kalcija hidrīdu, masa kļūst kvēlspuldze. Spēcīga hidrīda sildīšana ar hloru, bromu vai jodu izraisa kvēlspuldzi.
Hidrīda maisījumi ar dažādiem bromātiem, piemēram, bārija bromātu vai hlorātiem, piemēram, bārija hlorāts un perhlorāti, piemēram, kālija perhlorāts, eksplodē pēc triturēšanas. CaH2 reaģē ar sudraba fluorīdu, ja tas tiek pakļauts berzei.
Šis savienojums jārīkojas inertā atmosfērā. Ja tas netiek pienācīgi apstrādāts, tas var nopietni apdraudēt laboratorijas personāla, glābēju un ķīmisko atkritumu apsaimniekotāju veselību un drošību (UC laboratorijas drošības centrs, 2013).
Ļoti bīstama saskarei ar ādu vai acīm, jo tā ir kairinoša. Ļoti bīstama saskarei ar ādu, jo tā var būt kodīga.
Tas ir arī bīstams, ja norij un ieelpo. Audu bojājumu apjoms ir atkarīgs no kontakta garuma. Saskare ar acīm var izraisīt radzenes bojājumus vai aklumu.
Saskare ar ādu var izraisīt iekaisumu un blisterus. Putekļu ieelpošana radīs kuņģa-zarnu trakta vai elpceļu kairinājumu, ko raksturo dedzināšana, šķaudīšana un klepus..
Smaga pārmērīga ekspozīcija var izraisīt plaušu bojājumus, nosmakšanu, bezsamaņu un pat nāvi. Acu iekaisumu raksturo apsārtums, kairinājums un nieze. Ādas iekaisumu raksturo nieze, pīlings, apsārtums vai dažreiz blisteri.
Atkārtota acu pakļaušana zemam līmenim var izraisīt acu kairinājumu. Atkārtota iedarbība uz ādu var izraisīt vietēju ādas bojājumu vai dermatītu.
Atkārtota putekļu ieelpošana var izraisīt atšķirīgu elpceļu kairinājumu vai plaušu bojājumu. Atkārtota vai ilgstoša putekļu ieelpošana var izraisīt hronisku elpceļu kairinājumu (Materiālu drošības datu lapa Kalcija hidrīda MSDS, 2005).
Ja nokļūst acīs, tās nekavējoties skalot ar lielu daudzumu ūdens vismaz 15 minūtes, reizēm pacelot augšējo un apakšējo plakstiņu..
Saskaroties ar ādu, nekavējoties skalot ar lielu daudzumu ūdens vismaz 15 minūtes, novēršot piesārņoto apģērbu un apavus.
Norīšanas gadījumā nevajadzētu izraisīt vemšanu. Jāizsauc indes kontroles centrs. Ieteicams atstāt izstāžu vietu un nekavējoties doties uz āru.
Ieelpošanas gadījumā, ja elpošana ir sarežģīta, ir nepieciešams piegādāt skābekli. Elpošana ar muti līdz mutei nav atļauta, ja cietušais ir lietojis vai ieelpojis vielu.
Mākslīgā elpošana jāuzsāk ar kabatas masku, kas aprīkota ar vienvirziena vārstu vai citu piemērotu elpošanas medicīnas ierīci. Visos gadījumos nekavējoties jāsaņem medicīniskā palīdzība.
Pārkraušana un uzglabāšana
Savienojums jāglabā sausā traukā, kas atrodas prom no karstuma. Tas jāglabā prom no aizdegšanās avotiem. Neieelpot putekļus. Šim produktam nedrīkst pievienot ūdeni
Nepietiekamas ventilācijas gadījumā izmantojiet piemērotus elpošanas aparātus, piemēram, filtru maska. Iedarbības gadījumā Jums jāmeklē medicīniskā palīdzība un jānorāda etiķete, cik vien iespējams. Izvairīties no saskares ar ādu un acīm.
Uzliesmojoši materiāli kopumā ir jāuzglabā atsevišķā drošības skapī vai uzglabāšanas telpā. Uzglabāt cieši noslēgtu.
Glabāt vēsā un labi vēdināmā vietā. Visām iekārtām, kas satur materiālu, lai izvairītos no elektriskām dzirkstelēm, jābūt iezemētām. Tvertnei jābūt sausai un vēsā vietā.
Tas ir neuzliesmojošs materiāls. Tomēr ugunsdzēsējiem ir jāvalkā piemērota iekārta, vienlaikus ugunsgrēks ugunsgrēkā ap šo ķīmisko savienojumu.
Nekad nav ieteicams izmantot ūdeni ugunsgrēka dzēšanai ap kalcija hidrīdu. Šim nolūkam var izmantot sausas smiltis, kā arī savienojumus, piemēram, nātrija hlorīdu un nātrija karbonātu.
Lai noņemtu kalcija hidrīda atkritumus, tas jāsadala, pievienojot 25 ml metanola katram gramam hidrīda slāpekļa atmosfērā maisot..
Kad reakcija ir pabeigta, ūdens tilpums tiek pievienots kalcija metoksīda savienojumam un izvadīts kanalizācijā ar lielu daudzumu ūdens (National Research Council, 1995)..
Lietojumi un lietojumprogrammas
Žāvēšanas līdzeklis
Kālija hidrīds ir relatīvi maigs žāvētājs. Šī iemesla dēļ šī savienojuma izmantošana kā žāvētājs ir drošāka salīdzinājumā ar vairāk reaktīviem līdzekļiem, piemēram, nātrija-kālija un nātrija metālu sakausējumiem. Reaģē ar ūdeni šādā veidā:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Šīs reakcijas hidrolīzes produktus, ūdeņradi (gāzi) un Ca (OH) 2 (ūdens maisījums), var atdalīt no ķīmiskā šķīdinātāja pēc filtrēšanas, destilācijas vai dekantēšanas procesa..
Šis ķīmiskais savienojums ir efektīvs desikants daudziem bāzes šķīdinātājiem, piemēram, amīniem un piridīnam. Dažreiz to izmanto pirms šķīdinātāju pirms žāvēšanas, pirms tiek izmantoti reaktīvāki desikanti.
Ūdeņraža ražošana
1940. gados šis savienojums bija pieejams kā ūdeņraža avots ar nosaukumu "Hydrolith"..
To ilgu laiku izmanto kā ūdeņraža avotu. To joprojām izmanto, lai ražotu tīru ūdeņradi dažādos eksperimentos, modernās degvielas šūnās un akumulatoru lietojumos (American Elements, S.F.)..
Savienojums ir plaši izmantots gadu desmitiem kā drošs un ērts līdzeklis, lai palielinātu gaisa balonus.
Tāpat laboratorijās tas tiek regulāri izmantots, lai eksperimentos iegūtu nelielu daudzumu ļoti tīra ūdeņraža. Dīzeļdegvielas mitruma saturu aprēķina pēc ūdeņraža, kas attīstīts pēc apstrādes ar CaH2.
Reduktors
Sildot no 600 līdz 1000 grādiem pēc Celsija, cirkonija oksīdu, niobiju, urānu, hromu, titānu, vanādiju un tantalu var samazināt, lai sagatavotu šo metālu pulveri, lai kalcija hidrīdu varētu izmantot metalurģijā. putekļus.
Turpmākā reakcija ilustrē veidu, kādā kalcija hidrīds darbojas kā reducējošs līdzeklis:
TiO + 2CaH2 → CaO + H2 + Ti
Trūkums kalcija hidrīda lietošanā
Šo ķīmisko savienojumu bieži vien izvēlas kā žāvēšanas līdzekli; Tomēr tam ir arī daži trūkumi:
-Šī savienojuma žāvēšanas darbība ir lēna, jo tā nešķīst nevienā šķīdinātājā, ar kuru tā nereaģē smagi.
-Šis pulvera savienojums nav savienojams ar daudziem šķīdinātājiem. Jūsu reakcija ar hlorogļūdeņražiem var izraisīt pat sprādzienus.
-To nevar izmantot šķīdinātāju atkausēšanai, jo tas nespēj novērst izšķīdušo skābekli.
-Kalcija hidrīda un kalcija hidroksīda diferenciācija ir diezgan sarežģīta, jo tā ir līdzīga.
Atsauces
- Amerikāņu elementi. (S.F.). kalcija hidrīds. Saturs iegūts no americanelements.com: americanelements.com.
- Kalcija hidrīds 7789-78-8. (2016). Izgūti no chemicalbook.com: chemicalbook.com.
- kalcija hidrīds. (s.f.). Saturs iegūts no ķīmijas skolēna: chemistrylearner.com.
- Materiālu drošības datu lapa Kalcija hidrīda MSDS. (2005. gada 10. oktobris). Izgūti no sciencelab.com: sciencelab.com.
- Nacionālais biotehnoloģijas informācijas centrs. (S.F.). PubChem Compound datu bāze; CID = 105052. Saturs iegūts no pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- valsts pētniecības padome. (1995). Piesardzīga prakse laboratorijā: ķimikāliju apstrāde un likvidēšana. Washinton: NationalAcademy Press.
- Karaliskā ķīmijas biedrība. (2015). kalcija hidrīda ID 94784. Saturs iegūts no chemspider.com: chemspider.com.
- UC centrs laboratorijas drošībai. (2013. gada 18. janvāris). standarta darba procedūra kalcija hidrīds. Saturs iegūts no chemengr.ucsb.edu: chemengr.ucsb.edu.


