Ķīmiskās aktivācijas enerģija Ko tas veido, aprēķināšana
The ķīmiskās aktivācijas enerģija (no kinētisko pētījumu viedokļa) attiecas uz vismazāko iespējamo enerģijas daudzumu, kas nepieciešams ķīmiskās reakcijas uzsākšanai. Saskaņā ar ķīmiskās kinētikas sadursmju teoriju ir teikts, ka visām kustīgajām molekulām ir noteikts kinētiskās enerģijas daudzums..
Tas nozīmē, ka jo lielāks ir jūsu kustības ātrums, jo lielāks ir jūsu kinētiskās enerģijas apjoms. Šajā ziņā molekulu, kas veic ātru kustību, nevar sadalīt fragmentos pati par sevi, tāpēc sadursmei starp to un citu molekulu ir jārīkojas tā, lai varētu notikt ķīmiskā reakcija..
Kad tas notiek - kad starp molekulām notiek sadursme - daļa no tās kinētiskās enerģijas tiek pārveidota par vibrācijas enerģiju. Tāpat, ja procesa sākumā kinētiskā enerģija ir augsta, molekulās, kas piedalās sadursmē, būs tik liela vibrācija, ka dažas no ķīmiskajām saitēm būs bojātas..
Šī saiknes pārtraukšana ir pirmais solis reaģentu pārveidošanā par produktiem; tas ir, to veidošanā. No otras puses, ja šī procesa sākumā kinētiskā enerģija ir neliela, tad parādīsies molekulu "atsitiena" fenomens, caur kuru tie būs praktiski neskarti..
Indekss
- 1 Ko tas veido??
- 1.1 Aktivēts komplekss
- 2 Kā tas tiek aprēķināts?
- 2.1 Ķīmiskās reakcijas aktivācijas enerģijas aprēķināšana
- 3 Kā aktivācijas enerģija ietekmē reakcijas ātrumu?
- 4 Aktivācijas enerģijas aprēķina piemēri
- 5 Atsauces
Ko tas veido??
Sākot no molekulu sadursmju koncepcijas, lai uzsāktu iepriekš aprakstītās ķīmiskās reakcijas, var teikt, ka ir minimāls enerģijas daudzums, kas nepieciešams, lai notiktu sadursme..
Tātad, ja enerģijas vērtība ir mazāka par šo nepieciešamo minimumu, tad pēc sadursmes vienkārši nemainīsies molekulas, kas nozīmē, ka tad, kad šī enerģija nav, attiecīgās sugas paliek praktiski neskartas un nenotiks jebkādas šīs šoka izraisītās izmaiņas.
Šajā ideju secībā minimālā enerģija, kas nepieciešama, lai notiktu pārmaiņas pēc sadursmes starp molekulām, tiek saukta par aktivācijas enerģiju.
Citiem vārdiem sakot, šokā iesaistītajām molekulām jābūt tādai kopējai kinētiskai enerģijai, kas ir vienāda ar vai lielāka par aktivācijas enerģiju, lai varētu notikt ķīmiskā reakcija..
Arī daudzos gadījumos molekulas saduras un izraisa jaunu sugu, ko sauc par aktivizētu kompleksu, struktūru, ko sauc arī par "pārejas stāvokli", jo tā pastāv tikai īslaicīgi.
To izraisa reaģentu sugas sadursmes dēļ un pirms reakcijas produktu veidošanās.
Aktivizēts komplekss
Iepriekš minētais aktivētais komplekss veido sugu, kurai ir ļoti zema stabilitāte, bet kurai savukārt ir liels potenciālās enerģijas daudzums.
Nākamajā diagrammā redzams reaģentu pārveidošanās par produktiem, kas izteikts enerģijas izteiksmē, un atzīmējot, ka veidotā aktivētā kompleksa enerģija ir ievērojami lielāka nekā reaģentu un produktu enerģija..
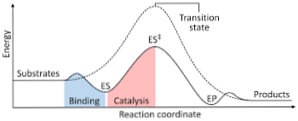
Ja reakcijas beigās produktiem ir lielāka stabilitāte nekā reaģentu vielām, enerģijas izdalīšanās notiek siltuma veidā, dodot eksotermisku reakciju..
Gluži pretēji, ja reaģenti izraisa lielāku stabilitāti nekā produkti, tas nozīmē, ka reakcijas maisījums izpaužas kā enerģijas absorbcija siltuma veidā no apkārtnes, kā rezultātā rodas endotermiska reakcija..
Tāpat, ja notiek viens vai otrs gadījums, ir jāizveido diagramma, piemēram, iepriekš parādīta diagramma, kurā attēlota sistēmas potenciālā enerģija, kas reaģē uz reakcijas progresu vai progresu..
Tādā veidā tiek iegūtas iespējamās enerģijas izmaiņas, kas rodas, kad reakcija turpinās, un reaģenti tiek pārvērsti produktos.
Kā tas tiek aprēķināts?
Ķīmiskās reakcijas aktivācijas enerģija ir cieši saistīta ar šīs reakcijas ātruma konstantu, un šī konstantes atkarība no temperatūras ir attēlota Arrhenius vienādojumā:
k = Ae-Ea / RT
Šajā izteiksmē k ir reakcijas ātruma konstante (kas ir atkarīga no temperatūras) un parametra A to sauc par frekvences koeficientu, un tas ir starpmolekulu sadursmju biežums.
Savukārt, e izsaka dabisko logaritmu sērijas pamatu. Tas tiek palielināts līdz jaudai, kas vienāda ar aktivācijas enerģijas negatīvo koeficientu (Ea) starp produktu, kas rodas no gāzes konstantes (\ tR) un absolūtā temperatūra (T) sistēmas apsvērt.
Jāatzīmē, ka frekvences koeficientu var uzskatīt par konstantu noteiktās reakcijas sistēmās plašā temperatūras diapazonā.
Šo matemātisko izpausmi sākotnēji paredzēja holandiešu izcelsmes ķīmiķis Jacobus Henricus van't Hoff 1884. gadā, bet kurš to zinātniski pamatoja un interpretēja savu premisu - zviedru dzimušais ķīmiķis Svante Arrhenius, 1889. gadā.
Ķīmiskās reakcijas aktivācijas enerģijas aprēķināšana
Arrhenius vienādojums norāda uz tiešu proporcionalitāti starp reakcijas ātruma konstantu un sadursmju starp molekulām biežumu..
Arī šo vienādojumu var attēlot ērtāk, piemērojot dabisko logaritmu īpašību katrai vienādojuma pusei, iegūstot:
ln k = ln A - Ea / RT
Pārkārtojot noteikumus, lai iegūtu līnijas vienādojumu (y = mx + b), tiek sasniegts šāds izteiksme:
ln k = (- Ea / R) (1 / T) + ln A
Tātad, veidojot ln k grafiku pret 1 / T, iegūstam taisnu līniju, kur ln k ir y koordinātes, (- A / R) ir līnijas slīpums (m), (1 / T) apzīmē koordinātu x, un ln A ir krustošanās ar koordinātu asi (b).
Kā redzams, no šī aprēķina izrietošais slīpums ir vienāds ar -Ea / R. Tas nozīmē, ka, ja ir vēlams iegūt aktivizācijas enerģijas vērtību, izmantojot šo izteiksmi, jāveic vienkāršs tīrīšanas process, kā rezultātā:
Ea = -mR
Šeit mēs zinām, ka m un R vērtība ir konstante, kas ir vienāda ar 8,314 J / K · mol.
Kā aktivācijas enerģija ietekmē reakcijas ātrumu?
Mēģinot veidot aktivizācijas enerģijas tēlu, to var uzskatīt par barjeru, kas nepieļauj reakciju starp zemākām enerģijas molekulām.
Tāpat kā kopējā reakcijā notiek, ka molekulu skaits, kas var reaģēt, ir diezgan liels, šo molekulu ātrums - un līdzvērtīgi - kinētiskā enerģija var būt ļoti mainīga..
Parasti gadās, ka tikai neliela daļa molekulu, kas saskaras ar sadursmi - tiem, kuriem ir lielāks kustības ātrums, ir pietiekami daudz kinētiskās enerģijas, lai varētu pārvarēt aktivizācijas enerģijas apjomu. Tātad šīs molekulas ir piemērotas un spējīgas būt reakcijas daļai.
Saskaņā ar Arrhenius vienādojumu negatīvā zīme, kas ir pirms aktivācijas enerģijas un gāzes konstantes rezultāta līdz absolūtai temperatūrai, nozīmē, ka ātruma konstante samazinās, jo palielinās aktivācijas enerģija, kā arī pieaugums, kad temperatūra pieaug.
Aktivācijas enerģijas aprēķina piemēri
Lai aprēķinātu aktivācijas enerģiju, veidojot grafiku, saskaņā ar Arrhenius vienādojumu, ir noteikts, ka acetaldehīda sadalīšanās reakcijas ātruma konstantes ir mērītas piecās dažādās temperatūrās un mēs vēlamies noteikt aktivācijas enerģiju. reakcijai, kas izteikta kā:
CH3CHO (g) → CH4g) + CO (g)
Piecu mērījumu dati ir šādi:
k (1 / M1/2· S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Pirmkārt, lai atrisinātu šo nezināmo un noteiktu aktivācijas enerģiju, mums ir jāizveido ln k vs 1 / T (y vs x) grafiks, lai iegūtu taisnu līniju un no šejienes paņemtu slīpumu un atrastu Ea vērtību, kā paskaidrots.
Mērījumu datu pārveidošana atbilstoši Arrhenius vienādojumam [ln k = (- Ea / R) (1 / T) + ln A] tiek noteiktas šādas vērtības y un x, attiecīgi:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
No šīm vērtībām un ar slīpuma matemātisko aprēķinu - vai nu datorā, vai kalkulatorā, ar izteiksmi m = (Y2-Y1) / (X2-X1) vai izmantojot lineārās regresijas metodi - iegūstam, ka m = -Ea / R = -2,09 * 104 K. Tātad:
Ea = (8,314 J / K · mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 102 kJ / mol
Lai noteiktu citas aktivācijas enerģijas, izmantojot grafisko ceļu, tiek veikta līdzīga procedūra.
Atsauces
- Vikipēdija. (s.f.). Aktivizācijas enerģija. Izgūti no en.wikipedia.org
- Chang, R. (2007). Ķīmija, devītais izdevums. Meksika: McGraw-Hill.
- Britannica, E. (s.f.). Aktivizācijas enerģija. Izgūti no britannica.com
- Moore, J. W. un Pearson, R. G. (1961). Kinētika un mehānisms. Izgūti no books.google.co.ve
- Kaesche, H. (2003). Metālu korozija: fizikāli ķīmiskie principi un pašreizējās problēmas. Izgūti no books.google.co.ve


