Ūdens elektrolīzes procedūra, metodes, kas tas ir, mājas eksperiments
The ūdens elektrolīze tā ir ūdens sadalīšanās tās pamatelementos, izmantojot elektrisko strāvu. Turpinot ūdeņradi un molekulāro skābekli veidojas uz divām inertām virsmām, H2 un O2. Šīs divas virsmas ir labāk pazīstamas ar elektrodu nosaukumu.
Teorētiski H tilpums2 jābūt divreiz lielākam par O2. Kāpēc? Tā kā ūdens molekulai H / O attiecība ir vienāda ar 2, ti, divi H katram skābeklim. Šo attiecību pārbauda tieši ar tās ķīmisko formulu, H2O. Tomēr iegūto tilpumu ietekmē daudzi eksperimentālie faktori.

Ja elektrolīze notiek caurulēs, kas iegremdētas ūdenī (augšējais attēls), zemāka augstuma ūdens kolonna atbilst ūdeņradim, jo ir lielāks gāzes daudzums, kas rada spiedienu uz šķidruma virsmu. Burbuļi ieskauj elektrodus un beidzas, kad beidzas ūdens tvaika spiediens.
Ņemiet vērā, ka caurules ir atdalītas viena no otras tā, ka gāzes ir nedaudz migrējušas no viena elektroda uz otru. Zemos svaros tas nenozīmē nenovēršamu risku; bet rūpnieciskajos svaros - H maisījuma gāzu maisījums2 un O2 Tas ir ļoti bīstams un sprādzienbīstams.
Šī iemesla dēļ elektroķīmiskās šūnas, kurās tiek veikta ūdens elektrolīze, ir ļoti dārgas; tiem ir vajadzīgs dizains un elementi, kas garantē, ka gāzes nekad nesajauc, ienesīgs strāvas padeve, augstas elektrolītu koncentrācijas, īpaši elektrodi (elektrokatalizatori) un mehānismi H uzglabāšanai.2 ražots.
Elektrokatalizatori ir berze un tajā pašā laikā spārni ūdens elektrolīzes rentabilitātei. Daži sastāv no cēlmetālu oksīdiem, piemēram, platīna un irīdija, kuru cenas ir ļoti augstas. Tieši šajā brīdī pētnieki apvieno spēkus, lai izstrādātu efektīvus, stabilus un lētus elektrodus.
Šo centienu iemesls ir paātrināt O2, kas ir zemāks ātrums, salīdzinot ar H2. Tas palēninās ar elektrodu, kurā tiek veidots O2 tas kopumā rada potenciālu, kas ir daudz lielāks nekā nepieciešams (pārspīlējums); tas pats, lai samazinātu veiktspēju un palielinātu izdevumus.
Indekss
- 1 Elektrolīzes reakcija
- 1.1. Pusi šūnu reakcijas
- 2 Procedūra
- 3 metodes
- 3.1 Elektrolīze ar sārmu ūdeni
- 3.2 Elektrolīze ar polimēru elektrolītisko membrānu
- 3.3 Elektrolīze ar cietiem oksīdiem
- 4 Kāda ir ūdens elektrolīzes izmantošana??
- 4.1. Ūdeņraža ražošana un tās izmantošana
- 4.2 Kā atkļūdošanas metode
- 4.3 Kā skābekļa padeve
- 5 Mājas eksperiments
- 5.1. Mājas mainīgie
- 6 Atsauces
Elektrolīzes reakcija
Ūdens elektrolīze ietver daudzus sarežģītus aspektus. Tomēr kopumā tā pamatā ir vienkārša globāla reakcija:
2H2O (l) => 2H2(g) + O2(g)
Kā redzams vienādojumā, divas ūdens molekulas iejaucas: viens parasti ir jāsamazina vai jāiegūst elektroni, bet otram ir jā oksidē vai zaudē elektronus..
H2 Tas ir ūdens samazināšanas produkts, jo elektronu pieaugums veicina protonu H+ var kovalenti saistīties, un skābeklis transformējas OH-. Tāpēc H2 notiek pie katoda, kas ir elektrods, kur notiek samazinājums.
Kamēr O2 nāk no ūdens oksidēšanās, jo tas zaudē elektronus, kas ļauj tai saistīties ar ūdeņradi, un tādējādi atbrīvo protonus H+. O2 notiek anodā, elektrodā, kur notiek oksidācija; un atšķirībā no citiem elektrodiem pH ap anodu ir skāba un nav pamata.
Pusi šūnu reakcijas
Iepriekšminēto var apkopot ar šādām ķīmisko vienādojumu pusšūnu reakcijām:
2H2O + 2e- => H2 + 2OH- (Katoda, pamata)
2H2O => O2 + 4H+ + 4e- (Anoda, skābe)
Tomēr ūdens nevar zaudēt vairāk elektronu (4e-), kuras otrā ūdens molekula uzvar katodā (2e-); tāpēc pirmais vienādojums ir jāreizina ar 2, un tad atņem ar otro vienādojumu, lai iegūtu neto vienādojumu:
2 (2H2O + 2e- => H2 + 2OH-)
2H2O => O2 + 4H+ + 4e-
6H2O => 2H2 + O2 + 4H+ + 4OH-
Bet 4H+ un 4OH- tie veido 4H2Vai arī tā novērš četras no sešām H molekulām2Vai atstājot divas; un rezultāts ir tikko radītā globālā reakcija.
Pusi šūnu reakcijas mainās ar pH vērtībām, paņēmieniem, un tām ir arī potenciāls samazināšanas vai oksidācijas potenciāls, kas nosaka, cik daudz strāvas ir jāpiegādā, lai ūdens elektrolīze spontāni sasniegtu.
Procedūra
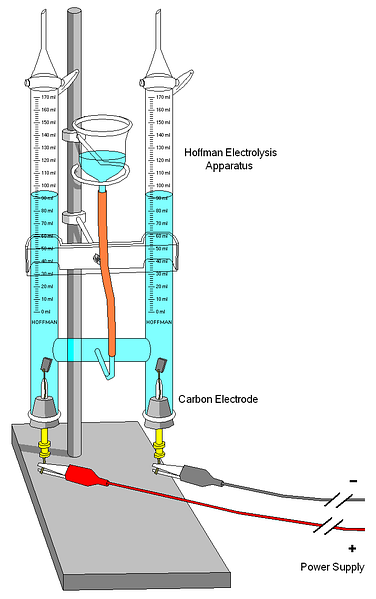
Augšējā attēlā redzams Hoffman voltmetrs. Cilindri ir piepildīti ar ūdeni un izvēlētie elektrolīti caur vidējo sprauslu. Šo elektrolītu nozīme ir ūdens vadītspējas palielināšana, jo normālos apstākļos ir ļoti maz H jonu3O+ un OH- Jūsu autoionizācijas produkti.
Abi elektrodi parasti ir platīns, lai gan attēlā tie tika aizstāti ar oglekļa elektrodiem. Abi ir savienoti ar akumulatoru, ar kuru tiek pielietota potenciālā starpība (ΔV), kas veicina ūdens oksidēšanos (O veidošanās).2).
Elektroni pārvieto visu ķēdi, līdz sasniedzat citu elektrodu, kur ūdens uzvar un kļūst par H2 un OH-. Šajā brīdī jau ir definēts anods un katods, ko var diferencēt ar ūdens kolonnu augstumu; mazāks augstums atbilst katodam, kur veidojas H2.
Cilindru augšdaļā ir daži taustiņi, kas ļauj izdalīt radušās gāzes. Jūs varat rūpīgi pārbaudīt H klātbūtni2 padarot to reakciju ar liesmu, kuras sadegšana rada gāzveida ūdeni.
Metodes
Ūdens elektrolīzes metodes atšķiras atkarībā no H daudzuma2 un O2 kas tiek ierosināts radīt. Abas gāzes ir ļoti bīstamas, ja tās sajauc kopā, un tāpēc elektrolītiskās šūnas ir komplicētas, lai samazinātu gāzveida spiediena pieaugumu un to difūziju caur ūdens vidi..
Arī paņēmieni svārstās atkarībā no šūnas, ūdenim pievienotā elektrolīta un pašiem elektrodiem. No otras puses, daži norāda, ka reakcija tiek veikta augstākās temperatūrās, samazinot elektroenerģijas patēriņu, un citi izmanto milzīgu spiedienu, lai uzturētu H2 glabā.
Visu paņēmienu vidū var minēt šādus trīs:
Elektrolīze ar sārmu ūdeni
Elektrolīzi veic ar sārmu metālu (KOH vai NaOH) bāzes šķīdumiem. Izmantojot šo metodi, rodas reakcijas:
4H2O (l) + 4e- => 2H2(g) + 4OH-(ac)
4OH-(ac) => O2(g) + 2H2O (l) + 4e-
Kā redzams, gan katodā, gan anodā ūdenim ir bāzes pH; un turklāt OH- migrē uz anodu, kur tie oksidējas uz O2.
Elektrolīze ar polimēru elektrolītisko membrānu
Šajā metodē tiek izmantots ciets polimērs, kas kalpo par H caurlaidīgu membrānu+, bet ūdensnecaurlaidīga gāzēm. Tas garantē lielāku drošību elektrolīzes laikā.
Šādā gadījumā pusi šūnu reakcijas ir:
4H+(ac) + 4e- => 2H2(g)
2H2O (l) => O2(g) + 4H+(ac) + 4e-
H joni+ viņi migrē no anoda uz katodu, kur tie tiek samazināti, lai kļūtu par H2.
Elektrolīze ar cietiem oksīdiem
Ļoti atšķiras no citām metodēm, un tā izmanto oksīdus kā elektrolītus, kas augstā temperatūrā (600-900ºC) darbojas kā anjona transporta līdzeklis.2-.
Reakcijas ir:
2H2O (g) + 4e- => 2H2(g) + 2O2-
2O2- => O2(g) + 4e-
Ņemiet vērā, ka šoreiz ir oksīda anjoni, OR2-, tie, kas ceļo uz anodu.
Kāda ir ūdens elektrolīzes izmantošana?
Ūdens elektrolīze rada H2 g) un O2 (g) Aptuveni 5% no pasaulē saražotās ūdeņraža gāzes ražo ūdens elektrolīze.
H2 tas ir NaCl šķīdumu elektrolīzes blakusprodukts. Sāls klātbūtne atvieglo elektrolīzi, palielinot ūdens elektrovadītspēju.
Globālā reakcija ir:
2NaCl + 2H2O => Cl2 + H2 + 2NaOH
Lai saprastu šīs reakcijas milzīgo nozīmi, tiks minēti daži gāzveida produktu izmantošanas veidi; jo dienas beigās tās ir tādas, kas attīsta jaunu metožu izstrādi, lai panāktu ūdens elektrolīzi efektīvāk un zaļāk.
Visiem no tiem visvairāk vēlams kalpot par šūnām, kas enerģiski aizvieto fosilā kurināmā izmantošanu.
Ūdeņraža ražošana un tās izmantošana
-Elektrolīzē iegūto ūdeņradi var izmantot ķīmijas rūpniecībā, kas darbojas atkarības reakcijās, hidrogenēšanas procesos vai reducējošā vielā reducēšanas procesos..
-Turklāt dažās komerciāli svarīgās darbībās ir svarīgi, piemēram: sālsskābes, ūdeņraža peroksīda, hidroksilamīnu uc ražošana. Iesaista amonjaka sintēzi ar katalītisku reakciju ar slāpekli.
-Kombinācijā ar skābekli tā ražo liesmas ar augstu kaloriju saturu ar temperatūru no 3 000 līdz 3500 K. Šīs temperatūras var izmantot metālrūpniecībā, sintētisko kristālu audzēšanai, kvarca ražošanai utt..
-Ūdens attīrīšana: pārāk augstu nitrātu saturu ūdenī var samazināt, likvidējot bioreaktoros, kuros baktērijas izmanto ūdeņradi kā enerģijas avotu.
-Ūdeņradis iejaucas plastmasas, poliestera un neilona sintēzes procesā. Turklāt tas ir daļa no stikla ražošanas, palielinot degšanu cepšanas laikā.
-Reaģē ar daudzu metālu oksīdiem un hlorīdu, t.sk. sudrabs, varš, svins, bismuts un dzīvsudrabs, lai iegūtu tīri metālus.
-Turklāt to izmanto kā degvielu hromatogrāfijas analīzēs ar liesmas detektoru.
Kā atkļūdošanas metode
Peldbaseina ūdens attīrīšanai izmanto nātrija hlorīda šķīdumu elektrolīzi. Elektrolīzes laikā katodā un hlorā tiek ražots ūdeņradis (Cl2) pie anoda. Šajā gadījumā tiek runāts par elektrolīzi kā sāls hlorinatoru.
Hlors izšķīst ūdenī, veidojot hipohloru skābi un nātrija hipohlorītu. Hidrohlorīdskābe un nātrija hipohlorīts sterilizē ūdeni.
Kā skābekļa padeve
Ūdens elektrolīzi izmanto arī, lai radītu skābekli Starptautiskajā kosmosa stacijā, kas kalpo, lai stacijā uzturētu skābekļa atmosfēru.
Ūdeņradi var izmantot kurināmā elementā, enerģijas uzglabāšanas paņēmienā un izmantot ūdenī, kas radīts šūnā, lai patērētu astronautus..
Mājas eksperiments
Ūdens elektrolīzes eksperimenti ir veikti laboratorijas svaros ar Hoffman voltmetriem vai citu komplektu, kas ļauj saturēt visus nepieciešamos elementus no elektrokemijas šūnas.
No visiem iespējamiem mezgliem un iekārtām visvienkāršākais var būt liels caurspīdīgs ūdens konteiners, kas kalpos kā šūna. Papildus tam jums ir jābūt arī jebkurai metāla vai elektriski vadošai virsmai, lai darbotos kā elektrodi; viens katodam un otrs - anodam.
Šim nolūkam var būt noderīgi pat abos galos asinātās zīmuļi ar grafīta punktiem. Un visbeidzot, mazs akumulators un daži kabeļi, kas to savieno ar improvizētajiem elektrodiem.
Ja tas netiek darīts caurspīdīgā traukā, gāzes burbuļu veidošanos nevarēja novērtēt.
Mājas mainīgie
Lai gan ūdens elektrolīze ir tēma, kas satur daudz intriģējošu un cerīgu aspektu tiem, kas meklē alternatīvus enerģijas avotus, mājas eksperiments var būt garlaicīgi bērniem un citiem skatītājiem..
Tāpēc H veidošanai var izmantot pietiekamu spriegumu2 un O2 mainot dažus mainīgos un atzīmējot izmaiņas.
Pirmais ir ūdens pH izmaiņas, izmantojot vai nu etiķi, lai paskābinātu ūdeni, vai Na2CO3 to mazināt. Ir jāmaina novēroto burbuļu daudzums.
Turklāt to pašu eksperimentu var atkārtot ar aukstu un karstu ūdeni. Tādējādi tiks apsvērta temperatūras ietekme uz reakciju.
Visbeidzot, lai datu vākšana būtu nedaudz mazāk bezkrāsaina, varat izmantot ļoti atšķaidītu purpura kāpostu sulas šķīdumu. Šī sula ir dabiskas izcelsmes bāzes skābes indikators.
Pievienojot to konteineram ar ievadītajiem elektrodiem, būs pamanīts, ka anodā ūdens kļūs sārtā krāsā (skābe), kamēr katodā krāsa būs dzeltena (pamata)..
Atsauces
- Vikipēdija. (2018). Ūdens elektrolīze. Saturs iegūts no: en.wikipedia.org
- Chaplin M. (2018. gada 16. novembris). Ūdens elektrolīze. Ūdens struktūra un zinātne. Saturs iegūts no: 1.lsbu.ac.uk
- Energoefektivitāte un atjaunojamā enerģija. (s.f.). Ūdeņraža ražošana: elektrolīze. Saturs iegūts no: energy.gov
- Phys.org. (2018. gada 14. februāris). Augstas efektivitātes, zemu izmaksu katalizators ūdens elektrolīzei. Saturs iegūts no: phys.org
- Ķīmija LibreTexts. (2015. gada 18. jūnijs). Ūdens elektrolīze. Saturs iegūts no: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. un S. Lewis N. (2016). Elektrolīzes sistēmu principi un ieviešana ūdens sadalīšanai. Karaliskā ķīmijas biedrība.
- Minesotas Universitātes valdnieki. (2018). Ūdens elektrolīze 2. Minesotas Universitāte. Saturs iegūts no: chem.umn.edu


