Sviestskābes formula, īpašības, riski un pielietojumi
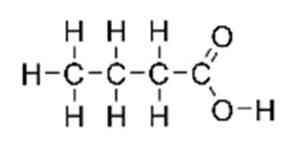
The sviestskābe, pazīstams arī kā n-butānskābe (IUPAC sistēmā), tā ir karboksilskābe ar strukturālo formulu CH3CH2CH2-COOH. Tas ir klasificēts kā īsa ķēdes taukskābe. Tam ir nepatīkama smarža, asa garša un tajā pašā laikā nedaudz salda (līdzīga ēterim), tās struktūra ir parādīta 1. attēlā..
Tas ir atrodams sevišķi rīsa sviestā, parmezāna sierā, svaigpienā, dzīvnieku taukos, augu eļļās un vemšanā. Tās nosaukums ir iegūts no grieķu vārda βουτυρος, kas nozīmē "sviests" (ziedotāji, 2016).
Taurskābe tiek veidota cilvēka resnajā zarnā, bakteriāli fermentējot ogļhidrātus (ieskaitot uztura šķiedras), un it kā nomāc kolorektālo vēzi.
Sviestskābe ir taukskābe, kas sastopama esteru veidā dzīvnieku taukos un augu eļļās. Interesanti, ka vājskābes zemas molekulmasas esteri, piemēram, metilbutirāts, lielākoties ir patīkami garšīgi vai garšīgi (metabolomiskās inovācijas centrs, S.F.)..
Indekss
- 1 sviestskābes fizikālās un ķīmiskās īpašības
- 2 Reaktivitāte un bīstamība
- 3 Lietošana un ieguvumi veselībai
- 4 Atsauces
Taukskābes fizikālās un ķīmiskās īpašības
Sviestskābe ir bezkrāsains šķidrums ar nepatīkamu smaržīgu sviesta smaržu. Tam ir arī noteikta sviesta garša.
Tā molekulmasa ir 88,11 g / mol un blīvums 0,9528 g / ml istabas temperatūrā. Tā kušanas temperatūra ir -5,1 ° C, un tā viršanas temperatūra ir 163,75 ° C.
Savienojums šķīst ūdenī, etanolā un ēterī. Tas nedaudz šķīst oglekļa tetrahlorīdā. Tā ir vāja skābe, kas nozīmē, ka tā pilnībā neatdalās, tā pKa ir 4,82 (Nacionālais biotehnoloģijas informācijas centrs, S.F.).
Izomērs, 2-metilpropānskābe (izobutirols), (CH3) 2CHCO2H, ir atrodams gan brīvā stāvoklī, gan etilestrā dažās augu eļļās. Lai gan tas ir komerciāli mazāk svarīgs nekā sviestskābe (Brown, 2011).
Sviestskābe var reaģēt ar oksidētājiem. Kvēlspuldzes rodas ar hroma trioksīdu virs 100 ° C. Tie ir arī nesaderīgi ar bāzēm un reducētājiem. Var uzbrukt alumīnijam un citiem vieglajiem metāliem (BUTYRIC ACID, 2016).
Reaktivitāte un apdraudējumi
Sviestskābe tiek uzskatīta par viegli uzliesmojošu savienojumu. Nesaderīgs ar spēcīgiem oksidētājiem, alumīniju un citiem parastajiem metāliem, sārmiem, reducētājiem (Royal Society of Chemistry, 2015).
Savienojums ir ļoti bīstams saskarē ar ādu (var izraisīt apdegumus), ja norīts, nonākot saskarē ar acīm (kairinošs) un ieelpojot (var izraisīt smagu elpošanas ceļu kairinājumu)..
Smidzināšanas šķidrums vai migla var izraisīt audu bojājumus, īpaši acu, mutes un elpošanas ceļu gļotādās.
Viela ir toksiska plaušām, nervu sistēmai, gļotādām. Atkārtota vai ilgstoša vielas iedarbība var nodarīt kaitējumu šiem orgāniem, kā arī elpceļu kairinājums, kas izraisa biežus bronhu infekcijas uzbrukumus (Materiālu drošības datu lapa Butyric acid, 2013).
Ja nokļūst acīs, jāpārbauda, vai cietušajam ir kontaktlēcas un tās ir jānoņem. Cietušā acis 20 līdz 30 minūtes jāizmazgā ar ūdeni vai parasto sāls šķīdumu, vienlaikus zvanot uz slimnīcu.
Ja nonāk saskarē ar ādu, skarto zonu iegremdē ūdenī, noņemot un izolējot visu piesārņoto apģērbu. Viegli nomazgājiet visas skartās ādas vietas ar ziepēm un ūdeni. Ir jāsaņem medicīniskā palīdzība.
Ieelpošanas gadījumā piesārņoto vietu atstājiet vēsā vietā. Ja rodas simptomi (piemēram, sēkšana, klepus, elpas trūkums vai dedzināšana mutē, rīklē vai krūtīs), sazinieties ar ārstu..
Norīšanas gadījumā nevajadzētu izraisīt vemšanu. Ja cietušais ir apzināts un tam nav krampju, ķīmiskās vielas atšķaidīšanai jāievada viena vai divas glāzes ūdens un jāsazinās ar slimnīcu vai indes kontroles centru..
Ja cietušais ir konvulsēts vai bezsamaņā, neko nedodiet mutē, pārliecinieties, ka cietušā elpceļi ir atvērti un novietojiet cietušo uz sāniem ar galvu zemāk par ķermeni. Jānodrošina tūlītēja medicīniskā palīdzība.
Lietojumi un ieguvumi veselībai
Mazās molekulas masas sviestskābes esteri, piemēram, metilbutirāts, ir smaržas un garšas, parasti patīkami. Šī iemesla dēļ tās izmanto kā pārtikas un smaržu piedevas.
Butirāts, konjugētā sviesta skābes bāze, dabiski atrodams vairākos pārtikas produktos. To var pievienot arī kā piedevu vai aromatizētāju citā.
Putu skābes vai butirātu esteri tiek izmantoti augu eļļas mākslīgo garšu un esenču pagatavošanai. Butilamirāts ir aprikožu eļļas galvenā sastāvdaļa, bet metilbutirātu var atrast ananāsu eļļā.
Ananāsu eļļa tiek izmantota arī kā aromatizētājs, lai veicinātu kaulu augšanu, ārstētu zobārstniecības operācijas un ārstētu saaukstēšanos, iekaisis kakls un akūta sinusīts, saskaņā ar dabisko produktu ražotāja OCA Brazīliju (PULUGURTHA, 2015)..
Baktērijas, kas atrodamas kuņģa-zarnu traktā, var radīt ievērojamu daudzumu fermentācijas butirāta, diētiskās šķiedras un nesagremojamus ogļhidrātus. Ēdot šķiedru pārtiku, piemēram, miežus, auzas, brūnos rīsus un klijas, ir veselīgs veids, kā iegūt butirātu jūsu ķermenī.
Pētījumā, kas publicēts 2010. gada novembra izdevumā "Journal of Nutrition", norādīts, ka graudaugu milti, kas naktī bagāti ar nesagremojamiem ogļhidrātiem, varētu palielināt plazmas butirāta koncentrāciju nākamajā rītā..
Viņš piebilst, ka tas varētu būt mehānisms, ar kura palīdzību pilngraudi palīdz novērst diabētu un sirds slimības.
Taurskābe, piemēram, butirāts, tiek veidota cilvēka resnajā zarnā kā šķiedru fermentācijas produkts, un tas tiek piedāvāts kā faktors, kas izskaidro, kāpēc diētas ar augstu šķiedrvielu saturu aizsargā pret resnās zarnas vēzi..
Ir izpētītas vairākas hipotēzes par šo attiecību iespējamo mehānismu, ieskaitot to, vai butirāts ir svarīgs, lai saglabātu epitēlija šūnu normālu fenotipisko ekspresiju vai uzlabotu bojāto šūnu izņemšanu no apoptozes..
Citas sviesta skābes vai butirāta priekšrocības ir:
- Palīdzība ar svara zudumu.
- Samazina kairināto resnās zarnas sindromu (Andrzej Załęski, 2013).
- Krona slimības ārstēšana (Ax, S.F.).
- Cīnīties pret insulīna rezistenci.
- Tam ir pretiekaisuma iedarbība.
Atsauces
- Andrzej Załęski, A. B. (2013). Sviestskābe iekaisīga zarnu sindroma gadījumā. Przegla̜d Gastroenterologiczny, 350-353. Izgūti no ncbi.nlm.nih.gov.
- Ax, J. (S.F.). Kas ir sviestskābe? 6 Sviestskābes ieguvumi, kas jums jāzina. Saturs iegūts no draxe: draxe.com.
- Brown, W. H. (2011. gada 2. decembris). Sviestskābe (CH3CH2CH2CO2H). Izgūti no enciklopēdijas britannica: Atgūts no britannica.com.
- BUTYRISKĀBE. (2016). Izgūti no cameochemicals: cameochemicals.noaa.gov.
- dalībnieki, N. W. (2016. gada 22. decembris). Sviestskābe. Izgūti no jaunās pasaules enciklopēdijas: izgūti no newworldencyclopedia.org.
- Materiāla drošības datu lapa sviestskābe. (2013. gada 21. maijs). Izgūti no sciencelab: sciencelab.com.
- Nacionālais biotehnoloģijas informācijas centrs. (S.F.). PubChem Compound datu bāze; CID = 264. Izgūti no PubChem: ncbi.nlm.nih.gov.
- PULUGURTHA, S. (2015, 1. jūnijs). Kādi pārtikas produkti ir augsta Butirāta sastāvā? Izgūti no livestrong: livestrong.com.
- Karaliskā ķīmijas biedrība. (2015). Butānskābe. Izgūti no chemspider: chemspider.com.
- metabolomiskās inovācijas centrs. (S.F.). Cilvēka vielmaiņas datu bāze, kas parāda sviesta skābes metabokardu. Saturs iegūts no hmdb.ca: hmdb.ca.


