Kalorimetru vēsture, detaļas, veidi un to raksturojums
The kalorimetrs ir ierīce, ko izmanto, lai izmērītu temperatūras izmaiņas zināmā īpatnējā siltuma vielas (parasti ūdens) daudzumā. Šī temperatūras izmaiņas ir saistītas ar siltumā, kas absorbēts vai atbrīvots pētāmā procesā; ķīmiska, ja tā ir reakcija, vai fiziska, ja tā sastāv no fāzes vai stāvokļa maiņas.
Laboratorijā vienkāršākais kalorimetrs ir kafijas tasītes. To izmanto, lai izmērītu siltumu, kas absorbēts vai atbrīvots reakcijā pie pastāvīga spiediena ūdens šķīdumā. Reakcijas tiek izvēlētas, lai izvairītos no reaģentu vai gāzveida produktu iejaukšanās.
 Eksotermiskā reakcijā izdalītā siltuma daudzumu var aprēķināt no kalorimetra un ūdens šķīduma temperatūras pieauguma:
Eksotermiskā reakcijā izdalītā siltuma daudzumu var aprēķināt no kalorimetra un ūdens šķīduma temperatūras pieauguma:
Reakcijā izdalītā siltuma daudzums = kalorimetra absorbētais siltums + šķīduma absorbētais siltuma daudzums
Kalorimetra absorbēto siltuma daudzumu sauc par kalorimetra kaloriju. To nosaka, piegādājot zināmu daudzumu siltuma kalorimetram ar noteiktu ūdens daudzumu. Tad tiek mērīts kalorimetra temperatūras palielinājums un tajā esošais šķīdums.
Izmantojot šos datus un ūdens īpatnējo siltumu (4.18 J / g.ºC), var aprēķināt kalorimetra kaloriju jaudu. Šo jaudu sauc arī par kalorimetru.
No otras puses, ūdens šķīduma iegūtais siltums ir vienāds ar m · ce · Δt. Formulā m = ūdens masa, ce = ūdens īpatnējais siltums un Δt = temperatūras svārstības. Zinot visu, tad var aprēķināt eksotermiskās reakcijas radīto siltuma daudzumu.
Indekss
- 1 Kalorimetra vēsture
- 2 daļas
- 3 veidi un to raksturojums
- 3.1. Kafijas tasīte
- 3.2. Kalorimetriskais sūknis
- 3.3. Adiabātiskais kalorimetrs
- 3.4. Isoperiboliskais kalorimetrs
- 3.5 Plūsmas kalorimetrs
- 3.6 Kalorimetrs diferenciālā skenēšanas kalorimetrijai
- 4 Pieteikumi
- 4.1. Fizikāli ķīmijā
- 4.2 Bioloģiskās sistēmās
- 4.3 Skābekļa sūkņa kalorimetrs un kaloriju jauda
- 5 Atsauces
Kalorimetra vēsture
1780. gadā franču ķīmiķis A. L. Lavoisiers, ko uzskatīja par vienu no ķīmijas tēviem, izmantoja jūrascūciņu, lai izmērītu siltuma ražošanu ar savu elpošanu.
Kā? Izmantojot kalorimetram līdzīgu ierīci. Jūrascūciņas radīto siltumu apliecināja aparāta ieskautā sniega kausēšana.
Pētnieki A.L Lavoisier (1743-1794) un P. S. Laplasa (1749-1827) izstrādāja kalorimetru, kas tika izmantots, lai noteiktu ledus īpatnējo siltumu ar ledus kušanas metodi..
Kalorimetrs sastāvēja no alvas pārklāta cilindriska vārglāzes, lakota, turēja statīvu un iekšēji izbeigta ar piltuvi. Iekšpusē tika ievietots cits stikls, līdzīgi kā iepriekšējais, ar cauruli, kas iet caur ārējo kameru un kas bija aprīkots ar atslēgu. Otrā stikla iekšpusē bija režģis.
Šajā tīklā tika novietota būtne vai objekts, kura īpašais siltums bija vēlams noteikt. Ledus novietoja koncentrisko kuģu iekšpusē, tāpat kā grozā.
Ķermeņa radīto siltumu absorbēja ledus, izraisot tās saplūšanu. Un tika savākts ledus kušanas šķidruma ūdens produkts, atverot iekšējā stikla atslēgu.
Visbeidzot, nosverot ūdeni, bija zināms izkausētā ledus masa.
Daļas
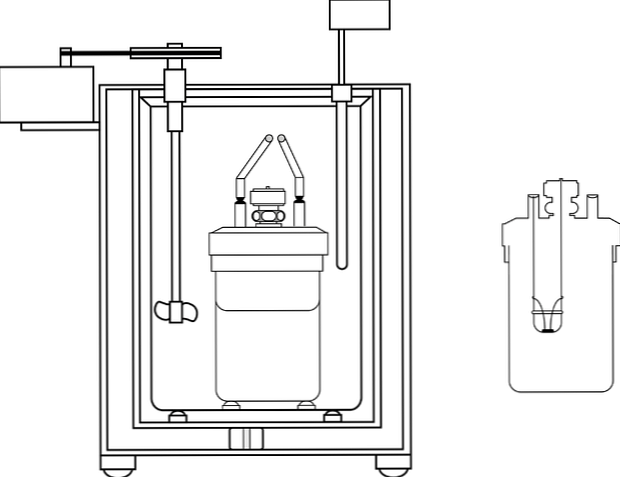
Ķīmijas mācību laboratorijās visbiežāk izmantotais kalorimetrs ir tā saucamais kafijas tases kalorimetrs. Šis kalorimetrs sastāv no vārglāzes, vai arī no anime materiāla, kam ir noteiktas izolācijas īpašības. Šajā traukā ūdens šķīdums tiek ievietots ķermenī, kas radīs vai absorbēs siltumu.
Konteinera augšējā daļā ir ievietots izolācijas materiāla pārklājums ar diviem caurumiem. Vienā vietā tiek ieviests termometrs, lai izmērītu temperatūras izmaiņas, bet otrā - maisītājs, vēlams no stikla materiāla, kas veic ūdens šķīduma satura pārvietošanu..
Attēlā redzamas kalorimetriskā sūkņa daļas; tomēr var konstatēt, ka tajā ir termometrs un maisītājs, kopīgi elementi vairākos kalorimetros.
Veidi un to raksturojums
Kafijas tasīte
Tas ir tāds, ko izmanto, lai noteiktu eksotermiskās reakcijas radīto siltumu, un endotermiskā reakcijā absorbētais siltums.
Turklāt to var izmantot ķermeņa īpatnējā siltuma noteikšanai; tas ir, siltuma daudzums, kas nepieciešams, lai absorbētu gramu vielas, lai paaugstinātu temperatūru par vienu Celsija grādu. .
Kalorimetriskais sūknis
Tā ir ierīce, kurā tiek izmērīts siltuma daudzums, kas tiek atbrīvots vai absorbēts reakcijā, kas notiek pie nemainīga tilpuma.
Reakcija notiek spēcīgā tērauda traukā (sūknī), kas iegremdēts lielā ūdens daudzumā. Tas padara ūdens temperatūras izmaiņas nelielas. Tāpēc tiek pieņemts, ka izmaiņas, kas saistītas ar reakciju, tiek mērītas nemainīgā temperatūrā un tilpumā.
Iepriekš minētais norāda, ka darbs netiek veikts, kad reakcija tiek veikta kalorimetriskā sūknī.
Reakcija sākas, piegādājot elektrību, izmantojot kabeļus, kas pievienoti sūknim.
Adiabātiskais kalorimetrs
Tam ir raksturīga izolācijas konstrukcija, ko sauc par vairogu. Vairogs atrodas ap šūnu, kur notiek siltuma un temperatūras izmaiņas. Lai izvairītos no siltuma pārneses, tas ir savienots arī ar elektronisku sistēmu, kas uztur ļoti tuvu kameras temperatūrai.
Adiabātiskā kalorimetrā temperatūras starpība starp kalorimetru un tā apkārtni ir minimāla; kā arī samazināt siltuma pārneses koeficientu un siltuma apmaiņas laiku.
Tās daļas sastāv no:
-Šūna (vai konteiners), kas integrēta izolācijas sistēmā, ar kuru tiek mēģināts izvairīties no siltuma zudumiem.
-Termometrs, lai mērītu temperatūras izmaiņas.
-Sildītājs, kas savienots ar regulējamu elektrības sprieguma avotu.
-Un vairogs jau minēts.
Šāda veida kalorimetros var noteikt tādas īpašības kā entropija, Debye temperatūra un elektroniskais stāvokļa blīvums.
Isoperiboliskais kalorimetrs
Tā ir ierīce, kurā reakcijas šūna un sūknis iegremdē konstrukcijā, ko sauc par apvalku. Šajā gadījumā tā sauktais apvalks sastāv no ūdens, kas tiek turēts nemainīgā temperatūrā.
Šūnas un sūkņa temperatūra paaugstinās, kad sadedzināšanas procesā tiek izdalīts siltums; bet ūdens apvalka temperatūra tiek uzturēta noteiktā temperatūrā.
Mikroprocesors kontrolē kameras un apvalka temperatūru, veicot nepieciešamos noplūdes siltuma korekcijas, kas izriet no atšķirībām starp abām temperatūrām..
Šīs korekcijas tiek veiktas nepārtraukti un ar galīgo korekciju, pamatojoties uz mērījumiem pirms un pēc testa.
Plūsmas kalorimetrs
Kaliendera izstrādātajā ierīcē ir ierīce, kas pārvieto gāzi konteinerā ar nemainīgu ātrumu. Pievienojot siltumu, tiek mērīts šķidruma temperatūras pieaugums.
Plūsmas kalorimetru raksturo:
- Precīzs nemainīga plūsmas ātruma mērījums.
- Precīza siltuma daudzuma mērīšana šķidrumā caur sildītāju.
- Precīzs enerģijas patēriņa radītā gāzes temperatūras pieauguma mērījums
- Dizains, lai izmērītu gāzes spiedienu zem spiediena.
Kalorimetrs diferenciālās skenēšanas kalorimetrijai
To raksturo divi konteineri: vienā no tiem ir jāpārbauda paraugs, bet otrs ir tukšs vai tiek izmantots atsauces materiāls..
Abus kuģus silda ar nemainīgu enerģijas ātrumu, izmantojot divus neatkarīgus sildītājus. Kad sākas abu tvertņu sildīšana, dators uzkrās sildītāju siltuma plūsmas atšķirību pret temperatūru, tādējādi nosakot siltuma plūsmu..
Turklāt var noteikt temperatūras variāciju kā laika funkciju; un, visbeidzot, kaloriju jauda.
Programmas
Fizikāli ķīmijā
-Pamata kalorimetri, tipa kafijas tasi, ļauj izmērīt siltuma daudzumu, ko organisms atbrīvo vai absorbē. Viņi var noteikt, vai reakcija ir eksotermiska vai endotermiska. Turklāt var noteikt ķermeņa specifisko siltumu.
-Ar adiabātisko kalorimetru ir iespējams noteikt ķīmiskā procesa entropiju un valsts elektronisko blīvumu.
Bioloģiskajās sistēmās
-Mikrokalorimetrus izmanto, lai izpētītu bioloģiskās sistēmas, kas ietver mijiedarbību starp molekulām, kā arī notiekošās molekulārās konformācijas izmaiņas; piemēram, molekulas atklāšanā. Līnija ietver gan diferenciālo skenēšanu, gan izotermisko titrēšanu.
-Mikrokalorimetru izmanto mazu molekulu, bioterapeitisko līdzekļu un vakcīnu zāļu izstrādei.
Skābekļa sūkņa kalorimetrs un kaloriju jauda
Daudzu vielu sadegšana notiek skābekļa sūkņa kalorimetrā, un var noteikt tā kaloriju jaudu. Starp vielām, kas pētītas, izmantojot šo kalorimetru, ir: ogles un kokss; pārtikas eļļas, gan smagas, gan vieglas; benzīns un visas degvielas.
Lidmašīnu reaktoru degvielas veidi; degvielas atkritumi un atkritumu apglabāšana; pārtikas produkti un uztura bagātinātāji; lopbarības kultūras un piedevas dzīvnieku barībai; celtniecības materiāli; raķešu un propelentu degvielas.
Tāpat kalorimetriju nosaka ar kalorimetriju uzliesmojošu materiālu termodinamikas pētījumos; pētot enerģijas līdzsvaru ekoloģijā; sprāgstvielās un termiskajos pulveros un pamata termodinamikas metožu mācīšanā.
Atsauces
- Whitten, Davis, Peck & Stanley. Ķīmija (8. izdevums). CENGAGE Learning.
- González J., Cortés L. & Sánchez A. (s.f.). Adiabātiskā kalorimetrija un tās pielietojumi. Atgūts no: cenam.mx
- Vikipēdija. (2018). Kalorimetrs. Saturs iegūts no: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (2018. gada 22. jūnijs). Kalorimetra definīcija ķīmijā. Saturs iegūts no: thinkco.com
- Gillespie, Claire. (2018. gada 11. aprīlis). Kā darbojas kalorimetrs? Science. Saturs iegūts no: sciencing.com


