Vides ķīmijas studiju joma un pielietojumi
The vides ķīmija Tā pēta ķīmiskos procesus, kas notiek vides līmenī. Tā ir zinātne, kas ķīmisko principu izmanto, lai pētītu vides rādītājus un cilvēka darbību radīto ietekmi.
Turklāt vides ķīmijas projektēšana novērš, mazina un novērš esošos vides bojājumus.
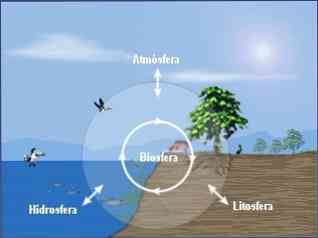
Vides ķīmiju var iedalīt trīs pamatnozarēs, kas ir:
- Atmosfēras vides ķīmija.
- Hidrosfēras vides ķīmija.
- Vides augsnes ķīmija.
Visaptveroša pieeja vides ķīmijai prasa arī pētījumus par to ķīmisko procesu savstarpējo saistību, kas notiek šajos trīs nodalījumos (atmosfērā, hidrosfērā, augsnē) un to attiecībās ar biosfēru..
Indekss
- 1 Vides ķīmija atmosfērā
- 1.1 -Stratosfēra
- 1.2 -Troposfēra
- 2 Hidrosfēras vides ķīmija
- 2.1 - Svaigs ūdens
- 2.2. Ūdens cikls
- 2.3. Antropoloģiskā ietekme uz ūdens ciklu
- 3 Vides augsnes ķīmija
- 3.1 Augsne
- 3.2 Antropoloģiskā ietekme uz augsni
- 4 Ķīmiskās vides attiecības
- 4.1 -Modelis Garrels un Lermans
- 5 Vides ķīmijas pielietojumi
- 6 Atsauces
Atmosfēras vides ķīmija
Atmosfēra ir zemes slānis, kas ieskauj Zemi; tā ir ļoti sarežģīta sistēma, kurā temperatūra, spiediens un ķīmiskais sastāvs mainās atkarībā no augstuma ļoti plašos diapazonos.
Saule bombardē atmosfēru ar starojumu un augstas enerģijas daļiņām; šim faktam ir ļoti būtiska ķīmiskā iedarbība visos atmosfēras slāņos, bet jo īpaši augstākajos un ārējos slāņos.
-Stratosfēra
Fotodisociācijas un fotoionizācijas reakcijas notiek atmosfēras ārējos reģionos. Reģionā no 30 līdz 90 km augstumā, kas mērīts no zemes virsmas, stratosfērā atrodas slānis, kas satur galvenokārt ozonu (OR3), ko sauc par ozona slāni.
Ozona slānis
Ozons absorbē augstu enerģētisko ultravioleto starojumu, kas nāk no saules, un, ja ne šī slāņa esamībai, nav zināms, ka dzīvē ir planēta..
1995. gadā atmosfēras ķīmiķi Mario J. Molina (Meksika), Frank S. Rowland (amerikāņu) un Paul Crutzen (holandieši) ieguva Nobela prēmiju ķīmijā par pētījumiem par ozona iznīcināšanu un noplicināšanu stratosfērā..
1970. gadā Crutzen parādīja, ka slāpekļa oksīdi iznīcina ozonu ar katalītiskām ķīmiskām reakcijām. Pēc tam Molina un Rowland 1974. gadā parādīja, ka hlorfluorogļūdeņražu savienojumu hlora (CFC) arī spēj iznīcināt ozona slāni.
-Troposfēra
Atmosfēriskais slānis tieši virs zemes virsmas, kas ir no 0 līdz 12 km augsts, ko sauc par troposfēru, galvenokārt sastāv no slāpekļa (N2) un skābekli (O2).
Toksiskas gāzes
Cilvēka darbības rezultātā troposfērā ir daudzas citas ķīmiskas vielas, ko uzskata par gaisa piesārņotājiem, piemēram:
- Dioksīds un oglekļa monoksīds (CO2 un CO).
- Metāns (CH4).
- Slāpekļa oksīds (NO).
- Sēra dioksīds (SO)2).
- Ozons O3 (uzskatāms par piesārņotāju troposfērā)
- Gaistošie organiskie savienojumi (GOS), pulveri vai cietas daļiņas.
Starp daudzām citām vielām, kas ietekmē cilvēku un augu un dzīvnieku veselību.
Skābais lietus
Sēra oksīdi (SO2 un SO3) un slāpekli, piemēram, slāpekļa oksīdu (NO2), izraisa citu vides problēmu, ko sauc par skābo lietu.
Šie oksīdi, kas atrodas troposfērā galvenokārt kā fosilā kurināmā sadegšanas produkti rūpnieciskajā darbībā un transportā, reaģē ar lietus ūdeni, kas ražo sērskābi un slāpekļskābi, un tādējādi rodas skābju nogulsnes.
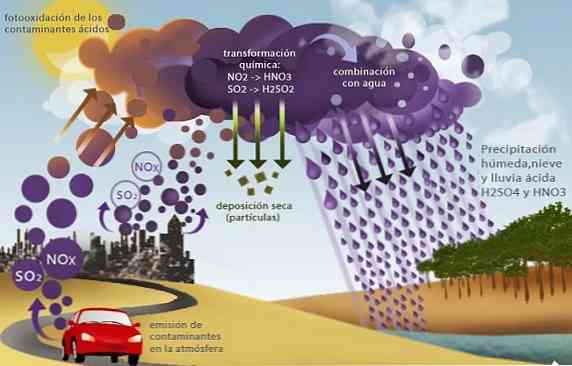
Piesūcinot šo lietus, kas satur stipras skābes, tas izraisa vairākas vides problēmas, piemēram, jūras un saldūdens paskābināšanu. Tas izraisa ūdens organismu nāvi; augsnes paskābināšana, kas izraisa kultūraugu nāvi un ēku, tiltu un pieminekļu ķīmisko koroziju izraisošu darbību;.
Citas atmosfēras vides problēmas ir fotoķīmiskā smoga, ko izraisa galvenokārt slāpekļa oksīdi un troposfēras ozons
Globālā sasilšana
Globālo sasilšanu rada augstas CO koncentrācijas2 atmosfēras un citas siltumnīcefekta gāzes (SEG), kas absorbē lielu daļu no zemes virsmas izstarotā infrasarkanā starojuma un slazdo siltumu troposfērā. Tas rada klimata pārmaiņas uz planētas.
Hidrosfēras vides ķīmija
Hidrosferu veido visi Zemes ūdensobjekti: virspusēji vai humedales - okeāni, ezeri, upes, avoti - un pazemes vai ūdens nesējslāņi..
-Svaigais ūdens
Ūdens ir visizplatītākā šķidrā viela uz planētas, aptver 75% zemes virsmas un ir absolūti nepieciešama dzīvībai.
Visas dzīvības formas ir atkarīgas no svaiga ūdens (definēts kā ūdens ar sāls saturu mazāk nekā 0,01%). 97% planētas ūdens ir sālsūdens.
No atlikušajiem 3% saldūdens 87% ir:
- Zemes stabi (kas kūst un ielej jūrā globālās sasilšanas dēļ).
- Ledāji (arī izzūdot).
- Gruntsūdeņi.
- Ūdens atmosfērā ir tvaika veidā.
Tikai 0,4% no planētas kopējā saldūdens ir pieejami patēriņam. Ūdens iztvaikošana no okeāniem un nokrišņu lietus nepārtraukti nodrošina šo nelielo procentuālo daudzumu.
Ūdens vides ķīmija analizē ķīmiskos procesus, kas notiek ūdens ciklā vai hidroloģiskajā ciklā, kā arī izstrādā tehnoloģijas cilvēku patēriņam paredzētā ūdens attīrīšanai, rūpniecisko un pilsētas notekūdeņu attīrīšanai, jūras ūdens atsāļošanai, pārstrādei. un saglabājot šo resursu, cita starpā.
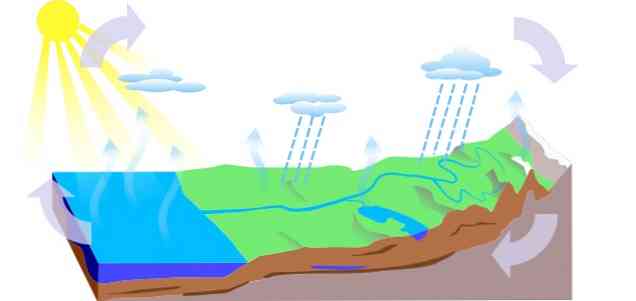
-Ūdens cikls
Ūdens cikls uz Zemes sastāv no trim galvenajiem procesiem: iztvaikošana, kondensācija un nokrišņi, no kuriem iegūst trīs ķēdes:
- Virsmas noteces
- Augu iztvaikošana
- Infiltrācija, kurā ūdens nokļūst pazemes līmeņos (gruntsūdens), cirkulē caur ūdens nesējslāņiem un iziet caur atsperēm, atsperēm vai akām..
-Antropoloģiskā ietekme uz ūdens ciklu
Cilvēka darbība ietekmē ūdens ciklu; Daži antropoloģiskās darbības cēloņi un sekas ir šādas:
Zemes virsmas pārveidošana
To rada mežu un mežu izciršanas iznīcināšana. Tas ietekmē ūdens ciklu, novēršot evapotranspirāciju (ūdens ņemšana caur augiem un atgriešanās vidē caur caurpūšanu un iztvaikošanu) un palielinot noteci.
Palielināta virsmas notece palielina upju plūsmu un plūdus.
Urbanizācija arī maina zemes virsmu un ietekmē ūdens ciklu, jo porainā augsne tiek aizstāta ar cementu un necaurlaidīgu asfaltu, kas padara infiltrāciju neiespējamu..
Ūdens cikla piesārņojums
Ūdens cikls ietver visu biosfēru un līdz ar to cilvēka radītie atkritumi šajā ciklā ir iekļauti dažādos procesos.
Ķīmiskais piesārņojums gaisā ir iestrādāts lietū. Agroķīmija, kas tiek uzklāta augsnē, cieš no izskalojuma un infiltrācijas ūdens nesējslāņos vai nokļūst upēs, ezeros un jūrās.
Arī no tauku un eļļu atkritumiem un poligonu izskalošanās ieplūst gruntsūdeņos.
Ūdens apgāde ar overdraftu ūdens resursos
Šīs prakses ar overdraftu, kas rada gruntsūdeņu un virszemes ūdeņu rezervju izsīkšanu, ietekmē ekosistēmas un rada vietējo augsnes pazemināšanos.
Vides augsnes ķīmija
Augsne ir viens no svarīgākajiem faktoriem biosfēras līdzsvarā. Tās nodrošina augiem enkuru, ūdeni un barības vielas, kas ir zemes trofisko ķēžu ražotāji.
Grīda
Augsni var definēt kā trīs posmu kompleksu un dinamisku ekosistēmu: cieto fāzi minerālūdens un organiskā nesējā, ūdens šķidruma fāzi un gāzes fāzi; raksturīgi ar noteiktu faunu un floru (baktērijas, sēnītes, vīrusi, augi, kukaiņi, nematodes, vienšūņi).
Augsnes īpašības pastāvīgi mainās sakarā ar vides apstākļiem un tajā attīstīto bioloģisko aktivitāti..
Antropoloģiskā ietekme uz zemes
Augsnes degradācija ir process, kas samazina augsnes ražošanas jaudu, kas spēj radīt dziļas un negatīvas izmaiņas ekosistēmā..
Augsnes degradāciju veicinošie faktori ir klimats, fiziogrāfija, litoloģija, veģetācija un cilvēka darbība.

Cilvēka rīcība var notikt:
- Augsnes fizikālā degradācija (piemēram, nepietiekamas audzēšanas un lopkopības prakses sablīvēšanās).
- Augsnes ķīmiskā noārdīšanās (paskābināšana, sārmaināšana, sāļošanās, piesārņojums ar agroķimikālijām, rūpnieciskās un pilsētas darbības notekūdeņi, naftas noplūde, cita starpā).
- Bioloģiskā augsnes degradācija (organisko vielu satura samazināšanās, veģetācijas seguma pasliktināšanās, slāpekļa fiksējošo mikroorganismu zudums).
Ķīmiskās vides attiecības
Vides ķīmija pēta dažādus ķīmiskos procesus, kas notiek trijās vides daļās: atmosfērā, hidrosfērā un augsnē. Ir interesanti pārskatīt papildu uzmanību vienkāršam ķīmiskam modelim, kas mēģina izskaidrot apkārtējā materiāla izplatību pasaulē.
-Modelis Garrels un Lermans
Garrels un Lermans (1981) izstrādāja vienkāršotu Zemes virsmas bioģeoķīmijas modeli, kas pēta atmosfēras, hidrosfēras, zemes garozas un biosfēras nodalījumu mijiedarbību..
Garrela un Lermenas modelis ņem vērā septiņus galvenos planētas minerālus:
- Apmetums (CaSO4)
- Pirīts (FeS2)
- Kalcija karbonāts (CaCO3)
- Magnija karbonāts (MgCO3)
- Magnija silikāts (MgSiO3)
- Dzelzs oksīds (Fe2O3)
- Silīcija dioksīds (SiO)2)
Organiskā viela, kas veido biosfēru (gan dzīvo, gan mirušo), ir attēlota kā CH2Vai tas ir aptuvenais dzīvo audu stehiometriskais sastāvs.
Garrela un Lermas modelī ģeoloģiskās izmaiņas tiek pētītas kā neto materiālu nodošana starp šīm astoņām planētas sastāvdaļām, izmantojot ķīmiskās reakcijas un neto masas saglabāšanas līdzsvaru..
CO uzkrāšanās2 atmosfērā
Piemēram, CO uzkrāšanas problēma2 atmosfērā ir pētīts šajā modelī, sakot, ka: šobrīd mēs biosfērā glabāto organisko oglekli, kā ogles, naftu un dabasgāzi, kas atrodas zemūdens glabāšanā pagātnes ģeoloģiskajos laikos, sadedzina.
Šī intensīvā fosilā kurināmā dedzināšanas rezultātā CO koncentrācija ir palielinājusies2 atmosfēras pieaug.
CO koncentrācijas pieaugums2 sauszemes atmosfērā tas ir tāpēc, ka fosilā oglekļa sadegšanas ātrums pārsniedz oglekļa absorbcijas ātrumu citos Zemes bioģeoķīmiskās sistēmas komponentos (piemēram, fotosintētiskos organismos un hidrosfērā).
Tādējādi CO emisija2 atmosfērā cilvēka darbības dēļ, pārsniedz regulatīvo sistēmu, kas modulē pārmaiņas uz Zemes.
Biosfēras lielums
Garrela un Lermana izstrādātais modelis arī uzskata, ka biosfēras lielums palielinās un samazinās, pateicoties līdzsvaram starp fotosintēzi un elpošanu..
Zemes dzīves laikā biosfēras masa pakāpeniski palielinājās ar augstu fotosintēzes ātrumu. Tas izraisīja organiskā oglekļa un skābekļa emisiju neto uzglabāšanu:
CO2 + H2O → CH2O + O2
Elpošana kā mikroorganismu un augstāku dzīvnieku vielmaiņas aktivitāte pārvērš organisko oglekli atpakaļ oglekļa dioksīdā (CO2) un ūdeni (H2O), tas ir, atceļ iepriekšējo ķīmisko reakciju.
Ūdens klātbūtne, organiskā oglekļa uzglabāšana un molekulārā skābekļa ražošana ir būtiskas dzīves pastāvēšanai.
Vides ķīmijas pielietojumi
Vides ķīmija piedāvā risinājumus cilvēka darbības izraisītā kaitējuma novēršanai, mazināšanai un novēršanai. Daži no šiem risinājumiem var minēt:
- Jaunu materiālu dizains, ko sauc par MOF (tā akronīms angļu valodā: Metāla organiskie ietvari). Tie ir ļoti poraini un spēj: absorbēt un saglabāt CO2, saņemt H2Vai gaisa tvaiks no tuksneša teritorijām un uzglabāt H2 mazos konteineros.
- Atkritumu pārveidošana par izejvielām. Piemēram, nolietotu riepu izmantošana mākslīgo zāli vai apavu zolēm. Arī kultūraugu apgriešanas atkritumu izmantošana biogāzes vai bioetanola ražošanā.
- CFC aizstājēju ķīmiskā sintēze.
- Alternatīvu enerģijas avotu, piemēram, ūdeņraža šūnu, attīstība tīras elektroenerģijas ražošanai.
- Atmosfēras piesārņojuma kontrole ar inertiem filtriem un reaktīviem filtriem.
- Jūras ūdens atsāļošana ar reversās osmozes palīdzību.
- Jaunu materiālu izstrāde ūdenī suspendēto koloidālo vielu flokulācijai (attīrīšanas process).
- Ezeru eitrofikācijas maiņa.
- "Zaļās ķīmijas" attīstība, kas piedāvā tendenci aizstāt toksiskas ķīmiskas vielas ar mazāk toksiskām vielām un "videi draudzīgas" ķīmiskās procedūras. Piemēram, tā tiek izmantota mazāk toksisku šķīdinātāju un izejvielu izmantošanā rūpniecībā, veļas mazgātavu ķīmiskā tīrīšanā..
Atsauces
- Calvert, J.G., Lazrus, A., Kok, G. L., Heikes, B.G., Walega, J.G., Lind, J. un Cantrell, C. A. (1985). Skābes radīšanas ķīmiskie mehānismi troposfērā. Nature, 317 (6032), 27-35. doi: 10.1038 / 317027a0.
- Crutzen, P.J. (1970). Slāpekļa oksīdu ietekme uz atmosfēras saturu. Q.J.R. Metheorol. Soc. Wiley-Blackwell. 96: 320-325.
- Garrels, R.M. un Lermans, A. (1981). Fenerozoikas ciklā nogulsnētais ogleklis un sērs. Dabas zinātņu akadēmijas darbi. ASV. 78: 4,652-4,656.
- Hester, R. E. un Harrison, R. M. (2002). Globālās vides pārmaiņas. Karaliskā ķīmijas biedrība. 205. lpp.
- Hites, R. A. (2007). Vides ķīmijas elementi. Wiley-Interscience. pp 215.
- Manahans, S.E. (2000). Vides ķīmija. Septītais izdevums. CRC 876. lpp
- Molina, M.J. un Rowland, F.S. (1974). Stratosfēras izlietne hlorfluormetāniem: hlora atomu katalizēta ozona iznīcināšana. Daba 249: 810-812.
- Morels, F.M. un Herings, J.M. (2000). Ūdens ķīmijas principi un pielietojumi. Ņujorka: John Wiley.
- Stockwell, W. R., Lawson, C.V., Saunders, E. un Goliff, W. S. (2011). Troposfēras atmosfēras ķīmijas un gāzes fāzes ķīmisko mehānismu pārskats gaisa kvalitātes modelēšanai. Atmosfēra, 3 (1), 1-32. doi: 10,3390 / atmos3010001


