Daltona postulātu atomu modelis
The Daltona atomu modelis vai Daltona atomu teorija, Tas bija priekšlikums, ko 1803. un 1807. gadā iesniedza angļu ķīmiķis un matemātiķis Džons Daltons. Tas bija pirmais konceptuālās organizācijas priekšlikums par atomu struktūru un darbību.
Daltona modelis ir pazīstams arī kā sfērisks modelis, jo tas piedāvā to, ka atoms ir nedalāma, cieta un kompakta sfēra. Pateicoties šim modelim, bija daudz vieglāk sniegt paskaidrojumu par ķīmiju pārējai pasaulei, un tas bija daudzu novatorisku pētniecības projektu pamatā. Varētu izskaidrot, kāpēc vielas dažās valstīs reaģēja.
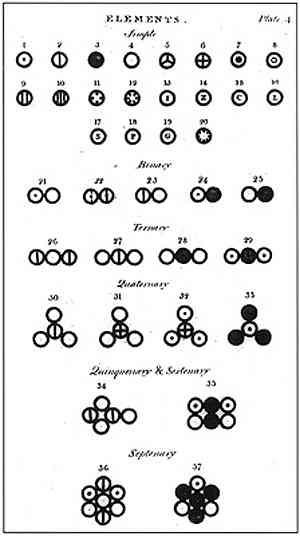
Saskaņā ar Daltonu, materiāls sastāvēja no minimālas vienības, ko sauc par atomu, kuru nevar iznīcināt vai sadalīt nekādā veidā. Šī vienība, ko agrāk piedāvāja Demokrits un viņa mentors Leucipo, bija Daltona pētījuma un viņa atomu modeļa radīšanas pamats..
Ar šo atomu teoriju Džons Daltons mēģināja pārņemt grieķu filozofu idejas par atoma esamību (Visuma atomu teorija), bet kā platformu izmantoja dažādus laboratorijas eksperimentus, kas ļāva viņam demonstrēt savas idejas.
Indekss
- 1 Daltona atomu modeļa postulāti
- 1.1. Postulēt 1
- 1.2. Postulāts 2
- 1.3. Postulāts 3
- 1.4. Postulāts 4
- 1.5. Postulāts 5
- 1.6. Postulāts 6
- 2 Dalton Atomic Model kļūdas
- 2.1 Ūdens formula
- 2.2 Atomu sastāvs
- 3 Secinājumi
- 4 Daltona galvenie ieguldījumi
- 4.1 Atomu teoriju prekursors
- 4.2 Viņš nodibināja mūsdienu ķīmijas pamatus
- 4.3 Vispirms publicējiet ķīmisko svaru tabulu
- 4.4 Norādiet krāsu aklumam
- 5 Interesanti raksti
- 6 Atsauces
Daltona atomu modeļa postulāti
Daltons formulēja savu atomu modeli ar 6 postulātiem, kurā viņš paskaidro, kā viņš pamatoja savus pētījumus un kā viņš tos veica.
Postulēt 1

Iepriekš minētajā attēlā ir attēlots Daltona modeļa kopsavilkums: atomi būtu nedalāmas, neiznīcināmas un viendabīgas sfēras.
Daltona pirmais postulāts norādīja, ka elementus veido sīkas daļiņas, ko sauc par atomiem, kurus nevar sadalīt, kā arī tos nevar iznīcināt.
Arī Daltons komentēja, ka šīs daļiņas nekādā ķīmiskā reakcijā nevar mainīties.
Postulāts 2

Daltona otrais postulāts noteica, ka visi atoma, kas atrodas vienā un tajā pašā elementā, ir vienāds ar svaru, kā citos raksturlielumos.
No otras puses, tas arī noteica, ka dažādu elementu atomiem ir atšķirīga masa. No šī priekšlikuma tika iegūtas zināšanas par relatīvajiem atomu svariem, kas tika demonstrēti, salīdzinot dažādus elementus ar ūdeņradi.
Postulāts 3

Trešajā Daltona postulātā konstatēts, ka atomi ir nedalāmi pat tad, ja tie ir kombinēti ķīmiskās reakcijās. Tās nevar arī radīt vai iznīcināt.
Atomu kombinācija, kas ir vienāda un atšķirīga, radīs sarežģītākus savienojumus, taču šis process nemainīs faktu, ka atoms ir minimālā vienības vienība..
Postulāts 4
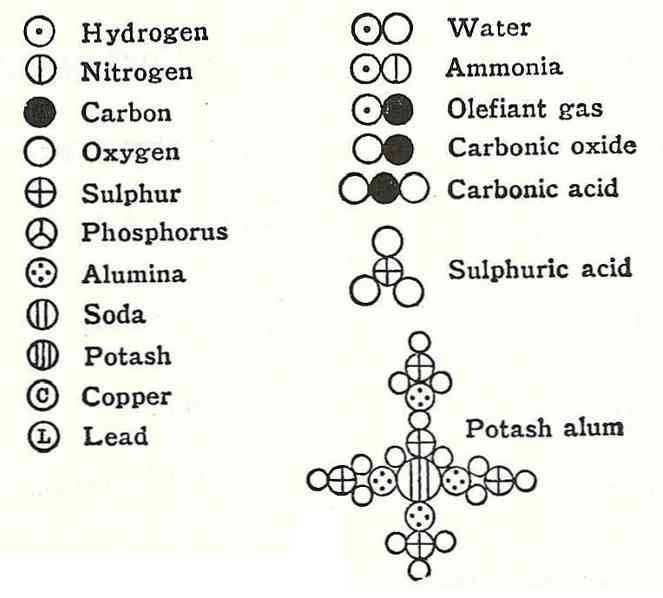
Ceturtā Daltona postulācija noteica, ka pat tad, ja atomi ir apvienoti, veidojot savienojumu, viņiem vienmēr būs sakarība, ko var izteikt vienkāršos un pilnos skaitļos. Šī izpausme netiks rādīta frakcijās, jo atomi ir nedalāmi.
Postulāts 5
Daltona piektais postulāts norādīja, ka ir iespējama dažādu atomu dažādu kombināciju kombinācija, lai veidotu vairāk nekā vienu savienojumu.
Tādā veidā varētu izskaidrot, ka no ierobežotā daudzuma atomiem ir atnācis viss esošais jautājums Visumā.
Postulāts 6
Daltona sestais un pēdējais postulāts norādīja, ka katrs ķīmiskais savienojums tika izveidots no divu vai vairāku dažādu elementu atomu kombinācijas.
Dalton Atomic Model kļūdas
Tāpat kā visas zinātnes pasaules teorijas, bija daudz noraidījumu attiecībā uz Daltona ierosināto modeli, kas gadu gaitā tika demonstrēts, atstājot aiz sevis Dalton inovatīvās idejas..
Ūdens formula
Kā piemēru var minēt Daltona argumentu par ūdens formulu, ko viņš teica, ka tas sastāvēja no ūdeņraža un skābekļa.
Šī apgalvojuma dēļ bija daudz kļūdu aprēķinos attiecībā uz dažu pamatvielu savienojumu masu un svaru, kas balstās uz šo informāciju.
Pēc dažiem gadiem Eiropas zinātnieki Gay-Lussac un Alexander von Humbodt atspēkoja šo informāciju un pierādīja, ka ūdens faktiski sastāvēja no diviem ūdeņražiem un viena skābekļa. 6 gadus vēlāk Amadeo Avogadro norādīja uz precīzu ūdens sastāvu un tā dēļ ir Avogadro likums..
Atomu sastāvs
No otras puses, divdesmitajā gadsimtā atklājās patiesais atomu sastāvs. Šajā gadījumā tika pierādīts, ka ir mazāka vienība, piemēram, protoni, elektroni un neitroni.
Līdzīgi parādījās arī dažādu Mendelejeva un Meijera periodiskajā tabulā noteikto atomu svaru esamība, izotopu esamība un specifiskākās ķīmiskās īpašības..
Secinājumi
Neskatoties uz savām kļūdām, Džona Daltona ieguldījums bija ļoti nozīmīgs zinātnes pasaulē, un viņa laikā viņš sajaucās, pateicoties lielajai informācijai, ko viņš sniedza..
Jūsu zinātniskais ieguldījums joprojām ir spēkā un vēl tiek pētīts.
Daltona atomu modelis gadu desmitu laikā netika apšaubīts, jo tas ir nozīmīgs zinātnes pasaulē un tā pareizais skaidrojums pētījumiem un hipotēzēm, kas tajā brīdī tika prezentētas zinātnes vēsturē..
Daltona galvenie ieguldījumi
Viņa ieguldījums zinātnes pasaulē galvenokārt bija izskaidrot un formulēt hipotēzes par dabu, izmantojot kvantitatīvus testus.
Zinātnieks nomira no sirdslēkmes 1884. gada 27. jūlijā Mančestrā un neilgi pēc tam, kad saņēma monarhijas atzinību.
Atomu teoriju prekursors
Džons Daltons bija angļu ķīmiķis, matemātiķis un ķīmiķis. Viņš piedzima 1766. gada 6. septembrī Cumberland, Apvienotajā Karalistē, un ir pazīstams kā viens no atomu teoriju prekursoriem no brīža, kad viņš iepazīstināja ar savu Atomu modeli..
Viņš nodibināja mūsdienu ķīmijas pamatus
Daltons ir pazīstams kā viens no priekšgājējiem, veidojot ķīmisko elementu relatīvo svaru tabulu. Šis fakts palīdzēja veidot pamatus mūsdienu mūsdienu ķīmijai.
Vispirms publicējiet ķīmisko svaru tabulu
Daltons bija pirmais zinātnieks, kam bija gods publicēt atomu svaru tabulu, kurā bija iekļauti tādi elementi kā ūdeņradis, skābeklis, fosfors, ogleklis un sērs. Pateicoties šai publikācijai, Daltons sāka strādāt un veidot savu atomu modeli.
Dodiet vārdu krāsu aklumam
Jāatzīmē, ka Daltons bija viens no pirmajiem, kas bija reģistrējies ar vizuālām problēmām, lai notvertu krāsas un viņam šis nosacījums ir nosaukts par krāsu aklumu.
Interesanti raksti
Schrödinger atomu modelis.
Broglijas atomu modelis.
Čadvika atomu modelis.
Heisenbergas atomu modelis.
Perrina atomu modelis.
Thomson atomu modelis.
Dirac Jordan atomu modelis.
Demokrātu atomu modelis.
Bohr atomu modelis.
Atsauces
- Daltona atomu teorija. Saturs iegūts 2017. gada 24. novembrī no Khanacademy: www.khanacademy.org
- Daltona Atomu teorija. Saturs iegūts 2017. gada 24. novembrī no Indiana Universitātes ziemeļrietumiem: iun.edu
- Atomu teorija. Saturs iegūts 2017. gada 24. novembrī no Encyclopædia Britannica: www.britannica.com
- Atomu teorija. Saturs iegūts 2017. gada 24. novembrī no Wikipedia: en.wikipedia.org
- Atomu struktūras vēsture. Saturs iegūts 2017. gada 24. novembrī, no Lumen: courses.lumenlearning.com.


